第293期:富硒畜禽产品与人类健康
原名:Selenium-enriched livestock and poultry products for human health
译名:富硒畜禽产品与人类健康
作者:牛琴剑1†,左刚2†,夏志远1,杨嘉成1,胡跃文3,刘广1*,孙铝辉1*
完成单位:
1 农业微生物资源发掘与利用全国重点实验室,湖北洪山实验室,华中农业大学动物科技学院,武汉 430070;
2 北京德元顺生物科技有限公司,北京 102200
3 湖南林熹生物科技有限公司,长沙 410200
期刊:中国科学:生命科学
发表日期:2024-11-20

摘要
硒(Se)是动物生长发育所必需的微量元素,在机体抗氧化、免疫调节、生殖繁育、物质代谢等生理过程中发挥着重要的作用。硒的缺乏会影响机体正常发育,导致各种疾病的发生,硒在动物体内主要以硒蛋白形式存在并发挥相应的生理功能,硒蛋白在维持机体氧化还原稳态、免疫调控、生殖系统发育等生理过程中发挥关键作用。文章系统地梳理了硒的发现、硒蛋白功能、动物生产中硒的作用以及畜禽富硒产品和人类健康的关系,强调了硒在生物体健康和动物生产中的重要性,探讨了硒与人类健康和开发富硒畜禽产品的有效措施,为利用富硒畜禽产品指导我国居民科学补硒提供科学依据。
关键词: 硒,科学补硒,富硒畜禽产品,硒蛋白功能
硒(Selenium,Se)是一种非金属化学元素,化学符号为Se,原子序数34,属于氧族元素。自然界中硒主要以无机硒和有机硒两种形式存在。硒是动物生长发育所必需的微量元素之一,在维持动物机体氧化还原稳态、增强免疫功能、抗炎症、抗肿瘤、维持正常生殖繁育等生理过程中发挥关键作用。硒的生物功能形式为硒蛋白,是多种氧化还原相关的蛋白酶活性成分。
1 硒的起源与认知
硒最早是由瑞典化学家 Jöns Jacob Berzelius和 Johan Gottlieb Gahn于1817 年发现的,最初人们因为其对工人的毒性作用以及饲粮中硒过量添加导致雏鸡被毛油腻、成活率低,引起牛的神经和肌肉出现症状,所以硒发现后的约150年都被认为是一种毒性元素[1]。
硒的营养学研究始于1957年,Schwarz和Foltz发现饲粮硒可以预防大鼠肝坏死以及雏鸡渗出性素质病,首次证明了硒的营养功能[2]。在随后对硒营养的研究中,发现硒和维生素E具有一定的协同作用,两者的共同缺乏会使家畜患病,如:仔猪肝脏、心脏平滑肌病变;羔羊、犊牛骨骼肌白肌病;母牛胎盘留滞、公牛生殖力下降等[3],进而揭示了硒对动物健康的保护作用,因此硒被认为是动物不可或缺的微量营养素。1958年Schwarz等人最先发现了硒的抗氧化功能[4],1973年Rofruek证实硒是谷胱甘肽过氧化物酶(GPX)的关键组分,Flohe等人从纯化得到的GPX中证实其每分子亚基中含有一个硒原子,揭示了硒的第一个生物活性形式,进一步证实了硒调节机体氧化还原稳态的作用[5]。同年,世界卫生组织 (WHO)、世界粮农组织 (FAO)、世界贸易组织 (WTO)先后宣布硒是人类及动物机体必需的微量元素。此后,硒越来越多生物功能被揭示,如:在抗氧化、抗肿瘤、免疫调控和解毒等方面的潜在功能[6-7],使硒的生物学研究更加深入,并在此基础上展开硒及硒蛋白生理功能、硒发挥作用的分子机制等深入研究。
2 硒的生物活性
2.1 动物体内硒吸收代谢过程
通常情况下,饲粮中的硒能被单胃动物很好地消化吸收:亚硒酸盐或硒酸盐等无机形式的硒通过被动扩散的方式直接被小肠上皮吸收,亚硒酸盐的直接吸收率在50%-60%之间,硒酸盐几乎被完全吸收[8]。硒酸盐在动物体内经由门静脉转运至肝脏被进一步代谢为亚硒酸盐,亚硒酸盐在硫氧还蛋白还原酶 (TXNRDs)或谷胱甘肽 (GSH)的作用下通过蛋氨酸循环被还原为硒化物[9],硒化物在体内与蛋白结合,进而合成硒蛋白。硒代蛋氨酸 (SeMet)、硒代半胱氨酸 (Sec)等有机硒通过各种转运载体以主动运输的方式吸收。SeMet被吸收后一部分直接用于合成蛋白质,作为不受调节的硒储备沉积在肝脏、肌肉等组织中,另一部分SeMet通过蛋氨酸循环及转硫作用后生成Sec[10],Sec被硒半胱氨酸裂解酶裂解产生硒化物和一分子丙氨酸[11],其余SeMet则在γ裂解酶及去甲基化作用下生成硒化物用于硒蛋白合成[12]。当机体摄入的硒超出合成硒蛋白所需的量时,部分硒化物会在组织器官沉积中与半乳糖胺的第一颗碳原子结合形成硒糖 (硒-N-乙酰-D-半乳糖胺) [13],或是甲基化后通过尿液排出体内。
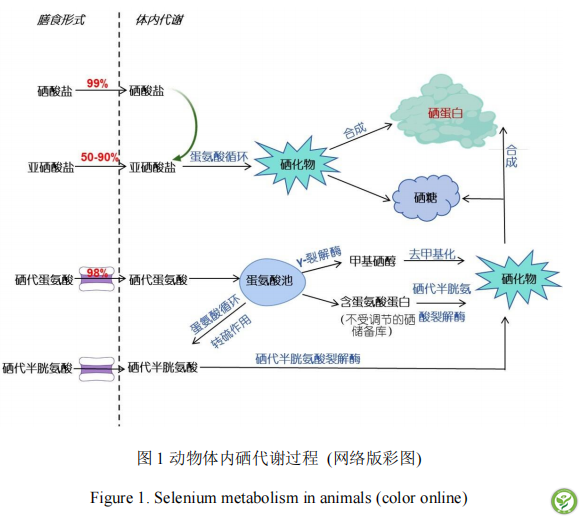
2.2 硒蛋白种类及功能
硒在动物体内主要通过硒蛋白形式发挥生物功能。目前在人、猪、牛、羊等哺乳动物体内已经鉴定出25种硒蛋白[14],包括谷胱甘肽过氧化物酶家族 (GPXs)蛋白、硫氧还蛋白还原酶、脱碘酶 (DIOs)及其他非酶硒蛋白。与哺乳动物不同的是鸡体内发现了24种硒蛋白,鸡体内缺失了硒磷酸合成酶2 (SEPHS2)、硒蛋白 V(SELENOV)和谷胱甘肽过氧化物酶6(GPX6),增加了硒蛋白U (SELENOU)和硒蛋白P2 (SELENOP2)[15],已在家禽体内发现 SEPHS2相应基因而未发现蛋白,鱼类硒蛋白合成效率更高,拥有更多硒蛋白种类,硒蛋白基因则在哺乳动物的基础上增加了一些亚型,各物种已鉴别出的差异硒蛋白见图 2。
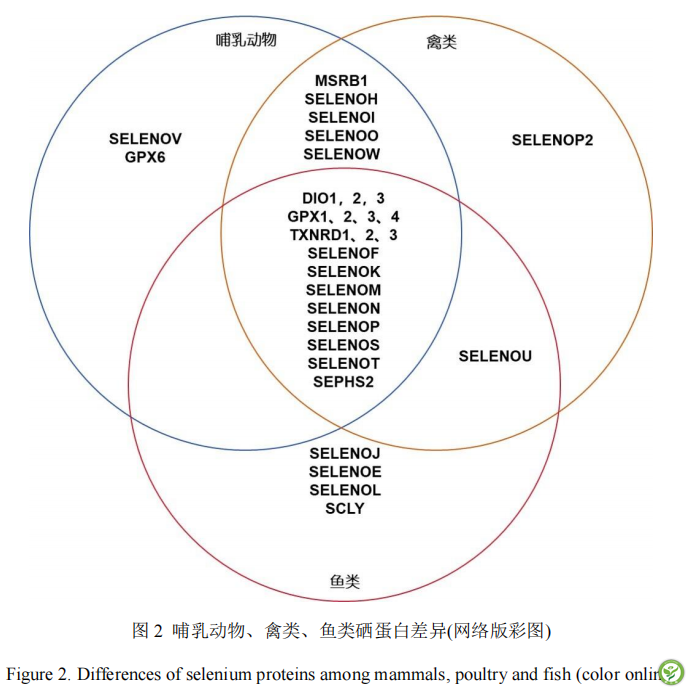
动物硒蛋白是指在编码基因指导下蛋白序列中插入Sec的具有生物活性的蛋白质。Sec残基主要位于硒蛋白活性位点的多肽主链上,是蛋白质的关键性功能基团,而Sec公认的主要作用是特异性参与氧化还原催化过程,因此除少数例外,硒蛋白大多是氧化还原酶,具有氧化还原活性,并分布在不同组织器官发挥不同多种功能(表 1)。例如:谷胱甘肽过氧化物酶家族,利用还原型谷胱甘肽作为硫醇供体催化过氧化氢等过氧化物的还原反应,维持氧化还原稳态。硫氧还蛋白酶家族利用还原型辅酶Ⅱ(NADPH)还原硫氧还蛋白、戊二醛还蛋白等化合物,维持机体还原稳态,并有信号转导功能。脱碘酶家族主要作用是催化三碘甲状腺原氨酸和四碘甲状腺原氨酸之间的转化,使甲状腺激素激活或失活,参与甲状腺激素代谢调节[16]。蛋氨酸亚砜还原酶B1(MSRB1),含有锌并能修复蛋白质中氧化的蛋氨酸残基,减少氧化损伤的蛋氨酸残渣。硒磷酸合成酶 2(SEPHS2),在所有脊椎动物形成Sec-tRNASec的第一步中催化硒化物生成硒磷酸盐[17]。硒蛋白P(SELENOP)是一种由肝脏合成分泌到血浆中的胞外糖蛋白,约占血浆硒含量的一半。SELENOP含有多个Sec残基,序列中间的Sec残基具有氧化还原活性,而序列末端的Sec残基起到硒运输作用,在缺硒状态下可以促进硒向组织转移[18-20]。硒蛋白 I(SELENOI)具有磷脂酰转移酶活性,催化形成磷脂酰乙醇胺[21]。硒蛋白 M(SELENOM)和硒蛋白 F(SELENOF)位于内质网,参与二硫键形成过程,与硒蛋白K(SELENOK)和硒蛋白S(SELENOS)同样具有可以降解错误折叠蛋白质的功能[22-23]。硒蛋白W和硒蛋白N在肌肉发育和分化中发挥重要作用。其余硒蛋白包括硒蛋白T、硒蛋白H、硒蛋白V、硒蛋白U主要参与机体氧化还原调控[23-24]。

3 硒在动物生产中的作用
3.1 硒与生长性能
硒具有促进动物生长的功能,可以促进生长激素的合成分泌。硒是维持甲状腺正常的生理代谢功能的必须元素,而甲状腺素T3参与了生长激素的生理合成过程,能够提高机体胰岛素水平,加速蛋白分解合成过程,促进动物生长发育[32],所以硒对动物生长的促进不可或缺。研究表明,在饲料中添加无机硒能有效提高裸颈鸡的采食量,添加有机硒则能显著提高其体增重和饲料转化效率[33]。在母猪饲料中添加酵母硒能有效提高仔猪第一周的平均体重,改善机体氧化应激状态[34]。
饲粮硒可以通过抑制依赖钙蛋白酶和泛素化的蛋白降解,促进肌纤维融合,从而促进白肌肥大,加速鱼类生长[35]。
3.2 硒与机体免疫
大量证据表明,硒会直接参与免疫器官的生长发育[36],影响体液免疫及细胞免疫等免疫功能的正常发挥。有研究证明,在饲粮中添加0.25和0.50 mg·kg-1硒对鸡坏死性肠炎的免疫反应有促进作用,而且能够降低宿主不良预后的风险[37]。硒还能缓解由T-2毒素导致的淋巴细胞耗竭及免疫因子减少[38]。饲喂母鸡含硒饲料后,能显著增加IL-2、IgM、IgA、sIgA、IgG 和 IFN-γ 的表达量,增强母鸡免疫力[39]。合理补充硒可通过诱导M1型巨噬细胞极化、树突细胞等淋巴细胞的
活化、增强自然杀伤细胞作用、调节T细胞增殖分化以及促进免疫因子IFN-γ、TNF-α等释放促进体液免疫和细胞免疫[40-43]。
3.3 硒与繁殖性能
硒在生殖系统发育、维持动物正常繁殖性能发挥着重要作用。研究表明,在饲粮中添加适量硒能够提高公畜精液品质,降低精子畸形率[44-46],对公畜睾丸发育及睾丸化学损伤保护也发挥着重要作用[47-50]。对于母畜而言,饲粮中补充硒能够提高其繁殖性能、提高子代免疫力;在妊娠母猪饲粮中添加0.3 mg·kg-1纳米硒能够显著提高母猪产仔数、缩短产程,提高母猪繁殖性能[51];在饲粮中添加适量硒可以显著提高蛋鸡产蛋率、种蛋品质及孵化率[39]。
3.4 硒与畜禽疾病
硒与畜禽健康息息相关。研究发现,动物日粮中缺硒会导致多种畜禽疾病发生,家禽在大规模集约化养殖时容易发生缺硒性疾病,目前已确定缺硒与禽类渗出性素质、法氏囊发育受阻和胃肠道损伤等疾病有关[52~54];猪在硒摄入不足时容易发生白肌病和消化系统疾病[55];反刍动物缺硒常常会导致肌肉损伤,发生白肌病[56]。过量摄入硒时会引起畜禽消瘦、脱蹄、脱毛等硒中毒现象,牛摄入过量含硒牧草会导致尾根毛脱落,采食量减少和消瘦,出现心肌和肝脏萎缩,肝硬化和胃肠炎症[57];肉鸡补硒过量出现死亡,解剖发现病死鸡只皮肤黏膜脱落,出现黄色胶样浸润物,肝脏和消化道淤血[58]。由于目前对硒引起的畜禽疾病机理认知不足,常常忽视了硒在养殖业中重要作用,给养殖业造成严重的经济损失。
4 富硒畜禽产品与人类健康
4.1 硒摄入量与人体健康
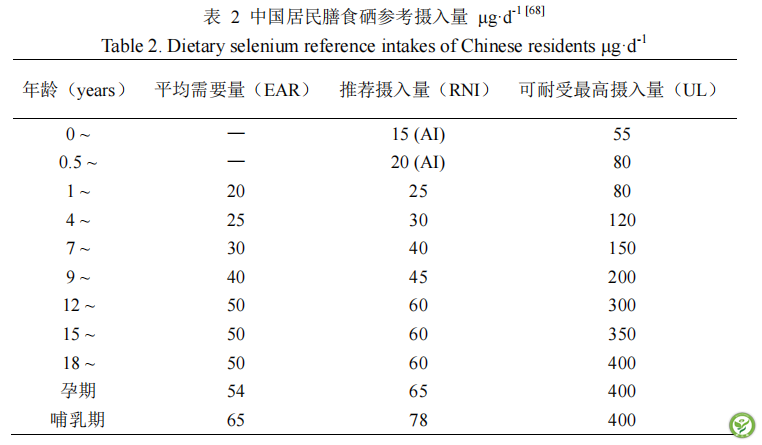
硒是维持人体健康的重要因素。硒的缺乏会导致人类的各种疾病,如大骨节病,克山病、动脉粥样硬化、高血压等心血管疾病,还有研究表明机体硒水平与炎症性肠病(IBD)(包括克罗恩病和溃疡性结肠炎)存在线性关联,在膳食中补充硒有助于减轻胃肠道炎症,恢复肠上皮屏障的完整性[59]。硒在调节糖尿病[60]、甲状腺疾病[61]等代谢病中发挥重要作用,硒过量会导致出现如糖尿病等代谢疾病[62~64],出现掉发,指甲脱落等硒中毒的现象[65]。目前的研究结果表明,人体血液硒含量和一些疾病诱导的死亡发生呈现U型关系,在血液硒含量低于105 μg·L -1或高于170 μg·L -1 时死亡率会显著上升,血液硒含量130-150 μg·L -1 时能确保处于安全状态,国际上硒研究领域认为,是否补硒,需要以人体血液中硒含量为准,一般在低于120 μg·L-1的时候建议补硒[66]。我国地壳平均硒含量为0.058 mg·kg-1,有70%以上的耕地不同程度的缺硒,30%的耕地缺硒严重,是世界上缺硒范围最大,程度最严重的国家之一。土壤缺硒将会间接导致生活在该地区人民的硒摄入量不足,人体在长期硒摄入量不足时容易引发一系列缺硒性疾病,对人体健康造成影响[67]。我国居民人均日常饮食中硒摄入量不到40 μg·d-1,为此在我国最新的2023版《中国居民膳食营养素参考摄入量》中对我国不同年龄阶段居民每日膳食硒提供了建议摄入量[68],见表2。
动物性食品是人体硒的主要来源,通过动物饲料中添加不同形式的硒,如:无机硒(硒化物、亚硒酸盐)、有机硒(硒代蛋氨酸、酵母硒)或是新型纳米硒等多种形式硒源,不同形式的硒在动物体内消化吸收后经过动物生理活动富集到畜禽产品中,人体摄入这些畜禽产品后达到高效补硒的目的,目前国内外对富硒畜禽产品的研究已取得较大进展,按照研究结果科学饲喂,进行富硒畜禽产品的生产,开发各种富硒畜禽产品以满足人体硒营养需要是解决我国缺硒问题的有效手段。
4.2 富硒畜产品开发
我国是世界上最大的猪肉生产和消费国,猪肉是我国主要的肉类消费品,猪肉将是我国富硒畜产品生产的关键载体。周迪等[69]研究饲料中添加0.3 mg·kg-1 不同工艺酵母硒(颗粒酵母硒、粉体酵母硒和水解酵母硒)与亚硒酸钠对育肥猪生长性能及组织中硒沉积的影响发现,添加不同硒源不会影响育肥猪生长性能,但添加酵母硒能显著增加育肥猪血清、肝脏和肌肉中硒沉积,在同样硒添加量时,水解酵母硒肌肉沉积硒含量达到0.30±0.02 mg·kg-1,肝脏中的硒含量更是达到 0.74±0.02 mg·kg-1。由此证明了酵母硒是一种对畜产品硒富集有效的硒源,水解酵母硒是三种工艺中最优质的工艺。据Rao等[70]报道,给断奶仔猪饲喂添加 0.3mg·kg-1 不同硒源的饲料35天,饲喂羟基蛋氨酸硒组平均日增重显著高于亚硒酸钠组,血清、肝脏和肌肉中硒沉积量显著高于亚硒酸钠组和酵母硒组,肌肉中硒含量达到 1.42±0.02 mg·kg-1,肝脏中硒含量达到 2.45±0.05 mg·kg-1,证明了羟基蛋氨酸硒作为生产富硒猪肉饲料中有效硒源的优势。此外,随着人们生活水平的提高和饮食结构的改变,牛、羊肉和奶制品的消费也在增加,Silva等[71]在饲料中添加不同剂量的亚硒酸钠和酵母硒饲喂内洛尔牛,发现在不影响牛生长性能、肉质和胴体性状的情况下,饲喂酵母硒的牛肉中硒含量均高于亚硒酸钠,饲料中添加2.7 mg·kg-1 酵母硒时,背最长肌中硒含量达到 0.37 mg·kg-1。孙玲玲等[72]人发现中国荷斯坦奶牛的饲料中添加 0.3 mg·kg-1的羟基蛋氨酸硒饲喂4周,牛乳中硒含量显著高于添加同剂量亚硒酸钠,达到 39.88 μg·kg-1,证明使用羟基蛋氨酸硒能更好生产富硒牛乳。
4.3 富硒禽产品开发
改革开放以来,我国家禽养殖业发展迅猛,根据国家统计局发布的数据显示目前我国禽肉产量世界第二,禽蛋产量世界第一。禽产品是我国消费普遍、相对廉价的动物产品,开发富硒禽产品能有效满足人体硒营养需求,是解决我国缺硒现状的重要手段。据龚发源等[73]人的研究,给海兰褐蛋鸡饲喂相同剂量不同工艺的酵母硒(颗粒酵母硒、粉体酵母硒和水解酵母硒)与亚硒酸钠,发现酵母硒和亚硒酸钠对产蛋性能无显著影响,但海兰褐蛋鸡硒的沉积率效果随着酵母硒饲喂时间而增加,第四周时粉体酵母硒可使蛋鸡体硒沉积率达到29.43%,硒总利用率达到72.78%,水解酵母硒使鸡蛋的硒沉积率达到54.44%。证明了使用酵母硒能够比亚硒酸钠更好的提高蛋鸡自身和鸡蛋的硒含量,粉体酵母硒对提高体硒沉积更有利,而水解酵母硒能更有效的提高鸡蛋中硒含量。Mohamed等[74]添加0.3 mg·kg-1的不同菌体硒蛋白与亚硒酸钠饲喂cobb肉鸡42天,发现添加亚硒酸钠组和基础日粮组胸肌的硒含量无显著差异,添加菌体硒蛋白均能显著提高胸肌的 硒含量,以 Enterobacter cloacae (ADS1)富集的菌体硒蛋白饲喂的胸肌中硒含量最高。Liu等[75] 添加不同剂量的酵母硒饲喂 AA 肉鸡 42 天,发现酵母硒对肉仔鸡生长性能没有显著影响,硒沉积数据拟合二次回归模型得出各组织硒沉积回归方程,该研究对使用酵母硒精确生产富硒鸡肉有着重要指导意义。
综上所述,国内外研究均表明有机硒源对富硒畜禽产品的生产效果更佳,使用酵母硒,羟基蛋氨酸硒和菌体硒蛋白都能高效提高畜禽产品中硒含量,添加 0.3 mg·kg-1水解酵母硒能在出栏前快速增加猪肉和鸡蛋中的硒含量,添加0.3 mg·kg-1羟基蛋氨酸硒能生产硒含量更高的牛奶, 而肉牛饲料中添加2.7 mg·kg-1酵母硒时能生产高富硒牛肉。根据中国农业技术推广协会2022年推行的《富硒农产品硒含量标准》,规定了肉类0.15-0.50 mg·kg-1,内脏 0.15-2.00 mg·kg-1,蛋类0.15-0.50 mg·kg-1,生乳0.075-0.30 mg·L-1为富硒畜禽产品的硒含量标准范围,为我国富硒畜禽产品开发提供参考,我国不同年龄居民通过参考表2推荐摄入量科学合理摄入富硒畜禽产品可有效解决我国居民因硒摄入不足导致的健康问题,在根据《富硒农产品硒含量标准》标准化生产富硒畜禽产品后,每天摄入 0.12 -0.4 kg富硒肉类或者2-7个均重60 g的富硒鸡蛋即可完全满足成年人每天所需硒摄入量,可以有效补硒。
5 小结
硒是生物体重要的微量元素,其生物功能主要通过硒蛋白发挥作用,尤其在维持机体氧化还原稳态、免疫调节、抗肿瘤等方面作用显著。大量研究表明,通过在饲料中添加不同形式的硒源,可以有效增加畜禽产品中的硒含量,有机硒(如酵母硒和羟基蛋氨酸硒)在动物体内的吸收和沉积效果优于无机硒,进而帮助人类通过膳食补充硒。未来研究可着重于进一步优化不同硒源的使用,深入探索硒对不同生理过程的分子机制,并开发更加高效、经济的富硒产品,以应对全球性
缺硒问题。总体而言,本文综述了硒的发现、硒蛋白功能、动物生产中硒的作用以及畜禽富硒产品和人类健康,强调了硒在生物体健康和动物生产中的重要性,探讨了硒与人类健康和开发富硒畜禽产品的有效措施,建议通过科学饲喂富硒饲料和标准化生产,来开发高效富硒畜禽产品,以应对缺硒问题,保障人类健康,为利用富硒畜禽产品指导我国居民科学补硒提供科学依据。
参考文献
1 FRANKE K W, TULLY W C. A New Toxicant Occurring Naturally in Certain Samples of Plant Foodstuffs. Poultry Science, 1935, 14(5): 273-9.
2 SCHWARZ K, FOLTZ C M. SELENIUM AS AN INTEGRAL PART OF FACTOR 3 AGAINST DIETARY NECROTIC LIVER DEGENERATION. Journal of the American Chemical Society, 1957, 79(12): 3292-3.
3 SHCHELKUNOV L F, DUDKIN M S, GOLUBKINA N A, et al. [Selenium and its role in nutrition]. Gig Sanit, 2000, (5): 32-5.
4 MUTH O H, OLDFIELD J E, REMMERT L F, et al. Effects of selenium and vitamin E on white muscle disease. Science, 1958, 128(3331): 1090.
5 ROTRUCK J T, POPE A L, GANTHER H E, et al. Selenium: biochemical role as a component of glutathione peroxidase. Science, 1973, 179(4073): 588-90.
6 CLARK L C, COMBS G F, JR., TURNBULL B W, et al. Effects of selenium supplementation for cancer prevention in patients with carcinoma of the skin. A randomized controlled trial. Nutritional Prevention of Cancer Study Group. Jama, 1996, 276(24): 1957-63.
7 ZHAO L, FENG Y, XU Z J, et al. Selenium mitigated aflatoxin B1-induced cardiotoxicity with potential regulation of 4 selenoproteins and ferroptosis signaling in chicks. Food Chem Toxicol, 2021, 154: 112320.
8 VAN DAEL P, DAVIDSSON L, MUÑOZ-BOX R, et al. Selenium absorption and retention from a selenite- or selenate-fortified milk-based formula in men measured by a stable-isotope technique. Br J Nutr, 2001, 85(2): 157-63.
9 KUMAR S, BJÖRNSTEDT M, HOLMGREN A. Selenite is a substrate for calf thymus thioredoxin reductase and thioredoxin and elicits a large non-stoichiometric oxidation of NADPH in the presence of oxygen. Eur J Biochem, 1992, 207(2): 435-39.
10 ESAKI N, NAKAMURA T, TANAKA H, et al. Enzymatic synthesis of selenocysteine in rat liver. Biochemistry, 1981, 20(15): 4492-6.
11 ESAKI N, NAKAMURA T, TANAKA H, et al. Selenocysteine lyase, a novel enzyme that specifically acts on selenocysteine. Mammalian distribution and purification and properties of pig liver enzyme. J Biol Chem, 1982, 257(8): 4386-91.
12 OKUNO T, MOTOBAYASHI S, UENO H, et al. Purification and characterization of mouse hepatic enzyme that converts selenomethionine to methylselenol by its alpha,gamma-elimination. Biol Trace Elem Res, 2005, 106(1): 77-94
13 KOBAYASHI Y, OGRA Y, ISHIWATA K, et al. Selenosugars are key and urinary metabolites for selenium excretion within the required to low-toxic range .Proc Natl Acad Sci U S A, 2002;99(25):15932-15936.
14 MARIOTTI M, RIDGE P G, ZHANG Y, et al. Composition and evolution of the vertebrate and mammalian selenoproteomes. PLoS One, 2012, 7(3): e33066.
15 LEI X G, COMBS G F, JR., SUNDE R A, et al. Dietary Selenium Across Species. Annu Rev Nutr, 2022, 42: 337-75.
16 LABUNSKYY V M, HATFIELD D L, GLADYSHEV V N. Selenoproteins: molecular pathways and physiological roles. Physiol Rev, 2014, 94(3): 739-77.
17 CARLISLE A E, LEE N, MATTHEW-ONABANJO A N, et al. Selenium detoxification is required for cancer-cell survival. Nat Metab, 2020, 2(7): 603-11.
18 HILL K E, ZHOU J, AUSTIN L M, et al. The selenium-rich C-terminal domain of mouse selenoprotein P is necessary for the supply of selenium to brain and testis but not for the maintenance of whole body selenium. J Biol Chem, 2007, 282(15): 109 72- 80.
19 SUNDE R A, SUNDE G R, SUNDE C M, et al. Cloning, Sequencing, and Expression of Selenoprotein Transcripts in the Turkey (Meleagris gallopavo). PLoS One, 2015, 10(6): e0129801.
20 SCHWARZ M, MEYER CE, LOSER A, et al. Excessive copper impairs intrahepatocyte trafficking and secretion of selenoprotein P. Nat Commun. 2023,14(1):3479.
21 MA C, MARTINEZ-RODRIGUEZ V, HOFFMANN P R. Roles for Selenoprotein I and Ethanolamine Phospholipid Synthesis in T Cell Activation. Int J Mol Sci, 2021, 22(20).
22 HOU X, WEI H, RAJAGOPALAN C, et al. Dissection of the Role of VIMP in Endoplasmic Reticulum-Associated Degradation of CFTRΔF508. Sci Rep, 2018, 8(1): 4764.
23 LEI X G, COMBS G F, JR., SUNDE R A, et al. Dietary Selenium Across Species. Annu Rev Nutr, 2022, 42: 337-75.
24 CHEN L L, HUANG J Q, XIAO Y, et al. Knockout of Selenoprotein V Affects Regulation of Selenoprotein Expression by Dietary Selenium and Fat Intakes in Mice. J Nutr, 2020, 150(3): 483-91.
25 TAMURA T, STADTMAN T C. A new selenoprotein from human lung adenocarcinoma cells: purification, properties, and thioredoxin reductase activity. Proc Natl Acad Sci U S A, 1996, 93(3): 1006-11.
26 PRASAD R, CHAN L F, HUGHES C R, et al. Thioredoxin Reductase 2 (TXNRD2) mutation associated with familial glucocorticoid deficiency (FGD). Journal of Clinical Endocrinology & Metabolism, 2014, 99(8): E1556-63.
27 BOUKHZAR L, HAMIEH A, CARTIER D, et al. Selenoprotein T Exerts an Essential Oxidoreductase Activity That Protects Dopaminergic Neurons in Mouse Models of Parkinson's Disease. Antioxid Redox Signal, 2016, 24(11): 557-74.
28 HAN S J, LEE B C, YIM S H, et al. Characterization of mammalian selenoprotein o: a redox-active mitochondrial protein. PLoS One, 2014, 9(4): e95518.
29 TAKEDA Y, SEKO A, HACHISU M, et al. Both isoforms of human UDP-glucose:glycoprotein glucosyltransferase are enzymatically active. Glycobiology, 2014, 24(4): 344-50.
30 JURYNEC M J, XIA R, MACKRILL J J, et al. Selenoprotein N is required for ryanodine receptor calcium release channel activity in human and zebrafish muscle. Proc Natl Acad Sci U S A, 2008, 105(34): 12485-90.
31 HORIBATA Y, ELPELEG O, ERAN A, et al. EPT1 (selenoprotein I) is critical for the neural development and maintenance of plasmalogen in humans. J Lipid Res, 2018, 59(6): 1015-26.
32 MA P, HU Z, LI L, et al. Dietary selenium promotes the growth performance through growth hormone-insulin-like growth factor and hypothalamic-pituitary-thyroid axes in grass carp (Ctenopharyngodon idella). Fish Physiol Biochem. 2021;47(4):1313-1327
33 KHAN M T, NIAZI A S, ARSLAN M, et al. Effects of selenium supplementation on the growth performance, slaughter characteristics, and blood biochemistry of naked neck chicken. Poult Sci, 2023, 102(3): 102420.
34 CAO J, LIU X, CHENG Y, et al. Selenium-enriched Polysaccharide: an Effective and Safe Selenium Source of C57 Mice to Improve Growth Performance, Regulate Selenium Deposition, and Promote Antioxidant Capacity. Biol Trace Elem Res, 2022, 200(5): 2247-58.
35 WANG L, ZHANG D, LI S, et al. Dietary Selenium Promotes Somatic Growth of Rainbow Trout (Oncorhynchus mykiss) by Accelerating the Hypertrophic Growth of White Muscle. Biol Trace Elem Res, 2021, 199(5): 2000-11.
36 LIANG L C, LI Q H, JIN J S, et al. Enhancing effect of Selenium on Immune function of Broilers (in Chinese). Journal of Beijing Agricultural University, 1993, (02): 99-103 [梁礼成, 李庆怀, 金久善, et al. 硒对肉鸡免疫功能的增强作用. 北京农业大学学报, 1993, (02): 99-103].
37 XU S Z, LEE S H, LILLEHOJ H S, et al. Dietary sodium selenite affects host intestinal and systemic immune response and disease susceptibility to necrotic enteritis in commercial broilers. Br Poult Sci, 2015, 56(1): 103-12.
38 ZHANG J, HAN Y, SONG M, et al. Selenium Improves Bone Microenvironment-Related Hematopoiesis and Immunity in T-2 Toxin-Exposed Mice. J Agric Food Chem, 2023, 71(5): 2590-9.
39 LIU J, WU D, LENG Y, et al. Dietary supplementation with selenium polysaccharide from selenium-enriched Phellinus linteus improves antioxidant capacity, immunity and production performance of laying hens. J Trace Elem Med Biol, 2023, 77: 127140.
40 CHEN W, LIU Z, ZHENG Y, et al. Selenium donor restricts the intracellular growth of Mycobacterium tuberculosis through the induction of c-Jun-mediated both canonical autophagy and LC3-associated phagocytosis of alveolar macrophages. Microb Pathog, 2021, 161(Pt B): 105269.
41 KUMARI M, PUROHIT M P, PAHUJA R, et al. Pro-inflammatory macrophage polarization enhances the anti-cancer efficacy of self-assembled galactomannan nanoparticles entrapped with hydrazinocurcumin. Drug Deliv Transl Res, 2019, 9(6): 1159-88.
42 LAI H, ZENG D, LIU C, et al. Selenium-containing ruthenium complex synergizes with natural killer cells to enhance immunotherapy against prostate cancer via activating TRAIL/FasL signaling. Biomaterials, 2019, 219: 119377.
43 MA C, HOFFMANN P R. Selenoproteins as regulators of T cell proliferation, differentiation, and metabolism. Semin Cell Dev Biol, 2021, 115: 54-61.
44 HORKY P, URBANKOVA L, BANO I, et al. Selenium Nanoparticles as Potential Antioxidants to Improve Semen Quality in Boars. Animals (Basel), 2023, 13(15).
45 EL-SHARAWY M, EID E, DARWISH S, et al. Effect of organic and inorganic selenium supplementation on semen quality and blood enzymes in buffalo bulls. Anim Sci J, 2017, 88(7): 999-1005.
46 SABZIAN-MELEI R, ZARE-SHAHNEH A, ZHANDI M, et al. Effects of dietary supplementation of different sources and levels of selenium on the semen quality and reproductive performance in aged broiler breeder roosters. Poult Sci, 2022, 101(10): 101908.
47 SHI L, SONG R, YAO X, et al. Effects of maternal dietary selenium (Se-enriched yeast) on testis development, testosterone level and testicular steroidogenesis-related gene expression of their male kids in Taihang Black Goats. Theriogenology, 2018, 114: 95-102.
48 CHEN X W, CHU J H, LI L X, et al. Protective mechanism of selenium on mercuric chloride-induced testis injury in chicken via p38 MAPK/ATF2/iNOS signaling pathway. Theriogenology, 2022, 187: 188-94.
49 ASADPOUR R, ALIYOLDASHI M H, SABERIVAND A, et al. Ameliorative effect of selenium nanoparticles on the structure and function of testis and in vitro embryo development in Aflatoxin B1-exposed male mice. Andrologia, 2020, 52(11): e13824.
50 XU Z J, LIU M, NIU Q J, et al. Both selenium deficiency and excess impair male reproductive system via inducing oxidative stress-activated PI3K/AKT-mediated apoptosis and cell proliferation signaling in testis of mice. Free Radic Biol Med, 2023, 197: 15-22.
51 MOU D, DING D, LI S, et al. Effect of maternal organic selenium supplementation during pregnancy on sow reproductive performance and long-term effect on their progeny. J Anim Sci, 2020, 98(12).
52 Zhao L, Liu M, Sun H, et al. Selenium deficiency-induced multiple tissue damage with dysregulation of immune and redox homeostasis in broiler chicks under heat stress.. Sci China Life Sci. 2023;66(9):2056-2069. doi:10.1007/s11427-022-2226-1.
53 YANG J C, HUANG Y X, SUN H, et al. Selenium deficiency dysregulates one-carbon metabolism in nutritional muscular dystrophy of chicks. Journal of Nutrition, 2023, 153(1): 47-55.
54 HUANG J Q, REN F Z, JIANG Y Y, et al. Selenoproteins protect against avian nutritional muscular dystrophy by metabolizing peroxides and regulating redox/apoptotic signaling. Free Radical Biology and Medicine, 2015, 83: 129-38.
55 LI J, ZHANG W, ZHOU P, et al. Selenium deficiency induced apoptosis via mitochondrial pathway caused by Oxidative Stress in porcine gastric tissues.. Res Vet Sci. 2022;144:142-148. doi:10.1016/j.rvsc.2021.10.017.
56 Han X M. Prevention and control measures of selenium poisoning and selenium deficiency in calves (in Chinese). China Animal Husbandry, 2024, (03):105-106 [韩祥民.犊牛硒中毒与硒缺乏的防治措施.中国畜牧业,2024,(03):105-106].
57 BAI X, LI F, LI F D, etc. The nutritional function and production application of selenium in ruminants (in Chinese). Chinese Journal of Animal Nutrition, 2021, 33(04):1880-1890 [白雪,李飞,李发弟,等.硒在反刍动物中的营养作用和生产应用.动物营养学报,2021,33(04):1880-1890].
58 WU Q F, WU T L. Excessive selenium supplementation causes selenium poisoning (in Chinese). Livestock and poultry industry, 2003, (6): 40-41. DOI: 10.19567 / j.carol carroll nki. 1008-0414.2003.06.024 [吴秋芬,吴廷莲.补硒过量引起硒中毒. 畜禽业,2003,(06):40-41.DOI:10.19567/j.cnki.1008-0414.2003.06.024].
59 KUDVA A K, SHAY A E, PRABHU K S. Selenium and inflammatory bowel disease. American Journal of Physiology - Gastrointestinal and Liver Physiology, 2015, 309(2): G71-7.
60 WANG X L, YANG T B, WEI J, et al. Association between serum selenium level and type 2 diabetes mellitus: a non-linear dose-response meta-analysis of observational studies. Nutrition Journal, 2016, 15(1): 48.
61 WICHMAN J, WINTHER K H, BONNEMA S J, et al. Selenium supplementation significantly reduces thyroid autoantibody levels in patients with chronic autoimmune thyroiditis: a systematic review and meta-analysis. Thyroid, 2016, 26(12): 1681-92.
62 GALAN-CHILET I, GRAU-PEREZ M, DE MARCO G, et al. A gene-environment interaction analysis of plasma selenium with prevalent and incident diabetes: The Hortega study. Redox Biol. 2017;12:798-805. doi:10.1016/j.redox.2017.04.022.
63 KOHLER LN, FLOREA A, KELLEY CP, et al. Higher Plasma Selenium Concentrations Are Associated with Increased Odds of Prevalent Type 2 Diabetes. J Nutr. 2018;148(8):1333-1340. doi:10.1093/jn/nxy099.
64 LI Z, LI X, JU W, et al. High serum selenium levels are associated with impaired fasting glucose and elevated fasting serum glucose in Linyi, China. J Trace Elem Med Biol. 2018;45:64-69. doi:10.1016/j.jtemb.2017.09.023.
65 CARDOSO BR, COMINETTI C, SEALE LA. Editorial: Selenium, Human Health and Chronic Disease. Front Nutr. 2022;8:827759. Published 2022 Jan 18. doi:10.3389/fnut.2021.827759.
66 RAYMAN MP. Selenium and human health. Lancet. 2012;379(9822):1256-1268. doi:10.1016/S0140-6736(11)61452-9.
67 The Chinese Nutrition Society released the 2023 edition of the Reference Intake of Dietary Nutrients for Chinese Residents (in Chinese). Journal of nutrition, 2023, (5) : 414. DOI: 10.13325 / j.carol carroll nki. Acta. Nutr. Sin. 2023.05.016 [中国营养学会发布《2023 版中国居民膳食营养素参考摄入量》 .营养学报, 2023,45(05):414.
68 GE K, YANG G. The epidemiology of selenium deficiency in the etiological study of endemic diseases in China. Am J Clin Nutr. 1993;57(2 Suppl):259s-63s.
69 ZHOU D, XU Z P, YUAN J, et al. Effects of different selenium sources on growth performance, serum antioxidant indexes and selenium deposition in finishing pigs (in Chinese). Feed in China, 2023, (21) : 217-220. [周迪,徐智鹏,袁婧,等. 不同硒源对育肥猪生长性能、血清抗氧化指标和硒沉积的影响中国饲料, 2023(21):217-220. DOI:10.15906/j.cnki.cn11-2975/s.202309010].
70 RAO ZX, TOKACH MD, WOODWORTH JC, et al. Evaluation of selenium source on nursery pig growth performance, serum and tissue selenium concentrations, and serum antioxidant status. Transl Anim Sci, 2023. 7(1): p. txad049.
71 SILVA JS, RODRIGUEZ FD, TRETTEL M, et al. Performance, carcass characteristics and meat quality of Nellore cattle supplemented with supranutritional doses of sodium selenite or selenium-enriched yeast. Animal. 2020;14(1):215-22.
72 SUN L L, WANG K, GAO S T, et al. Effects of different selenium sources on selenium content in plasma and milk and serum antioxidant capacity of lactating cows under short-term experimental conditions (in Chinese). Chinese Journal of Animal Nutrition, 2018,30(02):589-596 [孙玲玲,王坤,高胜涛,等. 短期试验条件下不同硒 源对泌乳奶牛血浆和乳中硒含量及血清抗氧化能力的影响. 动物营养学报, 2018,30(02):589-596].
73 GONG F Y, XU Z P, HUANG X, et al. Effects of different forms of yeast selenium on performance and selenium deposition efficiency of laying hens (in Chinese). Feed in China, 2023, (23) : 216-220. DOI: 10.15906 / j.carol carroll nki cn11-2975 / s. 2023100101 [龚发源,徐智鹏,黄鑫,等. 不同形式酵母硒对蛋鸡生产性能及硒沉积效率的影响研究.中国饲料, 2023(23):216-220. DOI:10.15906/j.cnki.cn11-2975/s.2023100101].
74 MOHAMED DA, SAZILI AQ, TECK CHWEN L, et al. Effect of Microbiota-Selenoprotein on Meat Selenium Content and Meat Quality of Broiler Chickens. Animals (Basel). 2020;10(6).
75 LIU J, WANG Z, LI C, et al. Effects of Selenium Dietary Yeast on Growth Performance, Slaughter Performance, Antioxidant Capacity, and Selenium Deposition in Broiler Chickens. Animals (Basel). 2023;13(24)




