论文ID
原名:Invited review: Mineral absorption mechanisms, mineral interactions that affect acid–base and antioxidant status, and diet considerations to improve mineral status.
译名:特邀综述:矿物质吸收机制,影响酸碱和抗氧化状态的矿物质相互作用,以及改善矿物质状态的饲粮因素
作者:Jesse P. Goff1
完成单位:
Biomedical Sciences, College of Veterinary Medicine, Iowa State University, Ames 50011.
期刊:J Dairy Sci.
影响因子:4.03
发表时间:2018-04

矿物质吸收机制
一、矿物质吸收的一般模型
饲粮中的矿物质必须通过胃肠道(GI)的上皮细胞吸收,进入血液供组织使用。矿物质可以在胃肠道的任何部位吸收。然而,大多数矿物质的大部分吸收都发生在小肠,因此将以小肠为模型表明矿物质吸收的一般过程。小肠和大肠都是由单层上皮细胞连接在一起的,并且这些细胞由一些蛋白质连接在一起,如occludins、claudins和e-cadherens,形成了相邻细胞之间的紧密连接。每个肠道上皮细胞的一部分细胞膜与肠道的腔体接触。这就是细胞的顶端表面。顶端膜被抛入许多细小的褶皱中,凸出到腔内。这些微绒毛,也被称为刷状边界,大大增加了可用于吸收的表面积。顶膜上覆盖着一层薄薄的粘液和糖蛋白层,称为糖萼,在此之上有一层未搅拌的水层通过表面张力附着在糖萼上。上皮细胞紧密连接下方的剩余表面与细胞外液接触,称为细胞的基底外侧膜。上皮细胞位于一个高度通透的蛋白质网状结构上,称为基底膜。在此之下是固有层。固有层是松散的结缔组织,内有细胞外液和丰富的血管和淋巴网络。淋巴管毛细血管,即乳糜微粒,吸收被包装成乳糜微粒的饲粮脂质,并回收可能从毛细血管床泄漏的血浆蛋白。血管毛细血管是有窗口的,内皮细胞之间有很大的开口,以方便糖、氨基酸和矿物质被吸收到血液中。这些细胞和紧密连接在一起,形成了一种有效的屏障,阻止大多数细菌和管腔内可能是毒素的大分子的入侵(图1)。这一屏障通常也会阻止糖、氨基酸和其他大的消化产物的通过。
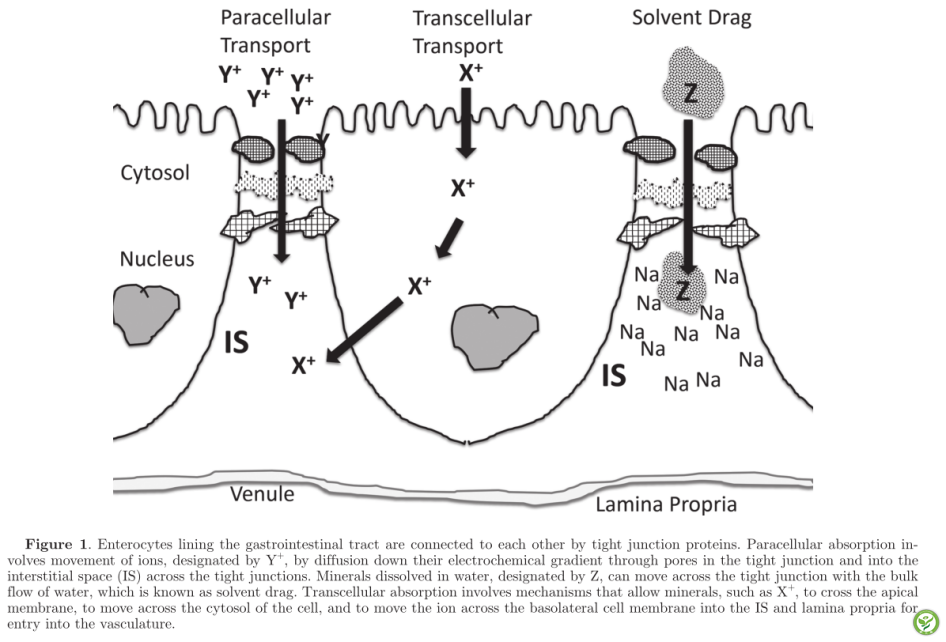
图1:胃肠道内层的肠上皮细胞通过紧密连接蛋白相互连接。细胞旁吸收涉及离子的运动,用Y+表示,通过紧密连接中的孔沿电化学梯度向下扩散,并穿过紧密连接进入间隙空间。溶解在水中的矿物质,用Z表示,可以随着水的大量流动穿过紧密的结合处,这就是所谓的溶剂阻力。跨细胞吸收涉及允许矿物质如X+穿过顶膜,穿过细胞的胞质溶胶,并使离子穿过基底外侧细胞膜进入IS和固有层进入脉管系统的机制。
细胞之间的紧密连接并不完全牢固。蛋白质网内有小裂缝、小孔和小通道,形成紧密连接。紧密连接的网状结构通常提供对矿物质(和水)吸收的阻力——也就是说,开口太小,不容易被矿物质渗透。此外,紧密连接处存在电位差(PD)——小肠中约+5 mV(管腔侧为负,间隙侧为正),大肠中高达+30mV,这为紧密连接处的阳离子吸收提供了阻力,但提供了促进跨紧密连接的阴离子吸收的力量。
如果溶解在紧密连接处管腔一侧液体中的自由电离状态的矿物质浓度大大超过另一侧间质间隙(相邻肠细胞之间的缝隙)内的细胞外液中的电离浓度,就可以克服跨越紧密连接处的运动阻力。电离矿物质浓度意味着该矿物质处于不与蛋白质或其他大物质结合的状态,处于溶液中。紧密连接两侧的离子化矿物质浓度差异所产生的扩散力可以很大,足以将矿物质通过紧密连接推入间质空间,并通过毛细血管内皮的开口,进入血液。这个过程被称为细胞旁吸收。当紧密连接处溶液中的矿物质浓度明显高于细胞外液中的矿物质浓度,就有可能发生。像所有由扩散驱动的过程一样,矿物原子的大小及其电荷也决定了矿物穿过紧密连接的难易程度。这个过程是不可饱和的——也就是说,它有无限的能力将矿物质输送到血液中。它仅受紧密连接腔侧溶液中离子化矿物质浓度产生的电化学梯度的限制。
紧密连接中的孔或离子通道引起了极大的兴趣。钙粘蛋白和封堵器蛋白的功能主要是将相邻的上皮细胞结合在一起并形成屏障,而Claudin蛋白似乎在控制紧密连接的通透性方面起着更积极的作用。Claudins是一个紧密连接蛋白家族,其氨基和羧基末端位于上皮细胞的胞质溶胶中。Claudin蛋白穿过细胞膜4次,并从细胞向外延伸,与相邻细胞的Claudin蛋白相互作用。超过26种Claudin蛋白已经被鉴定出来。Claudins 1、3和5似乎对封闭细胞间隙和管腔很重要——也就是说,它们收紧了紧密连接。它们可以在同一细胞中彼此形成二聚体,也可以与相邻细胞的Claudin蛋白形成二聚体。在某些情况下,Claudin蛋白(如Claudin 2和15)在孔隙区域内的氨基酸残基具有负电荷,它排斥阴离子并吸引阳离子进入孔隙,从而形成阳离子选择性孔。其他Claudins可能在紧密连接处形成阴离子选择性孔,但尚未在肠道中发现。一些Claudin蛋白,包括形成阳离子选择性孔的Claudin 2蛋白,也通过细胞之间的紧密连接形成水通道。已知上皮细胞胞浆中的Claudin蛋白部分与肌动蛋白细胞骨架蛋白相互作用,这表明细胞内细胞骨架的收缩可以影响细胞外Claudin蛋白形成的孔的大小。研究表明,管腔中葡萄糖和氨基酸的存在会影响允许水通过紧密连接的孔的大小。这对细胞骨架和紧密连接蛋白的影响尚不清楚。
细胞外矿物质吸收有两个重要方面(图1)。如上所述,只要存在电化学梯度来推动离子通过孔隙,矿物的简单扩散就可以通过紧密连接中的孔隙发生。当间隙空间中的矿物质浓度增加时,孔也会允许矿物质进入管腔,导致矿物质分泌。细胞旁矿物质吸收的第二个方面是悬浮在水中的矿物质通过紧密连接的孔隙移动。这就是所谓的溶剂阻力(图1)。自由矿物离子可以通过水偶极-离子相互作用保持在水中(溶解)。当水通过孔隙时,悬浮在水中的矿物质也能被吸收。与饲粮中各种物质(氨基酸、肽、短链脂肪酸)复合的矿物质,只要能溶于紧密连接处的非束缚水层,也能被溶剂拖曳吸收。只要被水溶解,大至3.5kDa的分子就能通过这些紧密连接的小孔。这些紧密连接的小孔直径可达10至30 A。由于每天有大量的水通过胃肠道被吸收,所以矿物质的溶剂阻力可能是动物吸收大部分所需矿物质的原因。当考虑水在紧密连接处的运动时,有两种力在起作用。一个是静水压力,水通常沿着阻力最小的路径流动。紧密连接对肠腔内水压的增加有相当大的抵抗力。水沿着血管向下流动,而不是通过紧密的连接处。将管腔内水压提高到22cm H2O并不会增加吸水率。然而,当流体在紧密连接下方的间隙中积聚时,它会提高间隙内的流体静压。紧密连接似乎对间隙空间静水压力非常敏感,因为将间隙水压升至2cm H2O可消除水的吸收,超过该范围的压力增加会导致水进入管腔。水分运动的第二个作用力是渗透压。水通过紧密连接孔进入间隙空间的质量运动几乎完全取决于间隙空间中渗透梯度的发展。钠是间隙渗透压的主要贡献者。上皮细胞通过其顶膜吸收钠,并使用3 Na+/2 K+ ATP酶电泵将其泵入间质空间。可能与钠离子共转运的溶质如氯化物、葡萄糖和氨基酸也有助于间隙的渗透压。在瘤胃中,挥发性脂肪酸的吸收有助于瘤胃上皮下方的渗透梯度,并有助于将水拉过瘤胃上皮。水以及溶解在水中的矿物质和分子将通过水进入间隙并从那里进入固有层内的毛细血管床。同样,水的这种运动可以发生在两个方向。溶剂拖曳也可以将矿物质移出管腔,尤其是如果间隙空间中的流体静压力增加,这可能发生在消化过程中小肠上部的正常收缩过程中。如果肠道灌注受到损害并对肠毒素产生反应,导致水分泌的间隙静水压也会增加。水和电解质的大量流动在上小肠比在下小肠更自由。这可能是由于上肠存在较大的水孔。
胃肠道内的上皮细胞有一层包含磷脂双层的细胞膜,它有效地阻止了水的运动,使其比紧密连接更不受水携带的矿物质扩散的影响。溶液中的大多数矿物质还带有正电荷或负电荷,这也会阻止它们越过脂质双层屏障。与覆盖在上皮细胞顶端表面的消化液和基侧细胞表面外的细胞外液相比,上皮细胞内部是负电荷。此电荷介于−25和−40 mV之间,称为跨膜的PD。带负电荷的矿物质离子(如Cl)试图逆电梯度从肠腔进入细胞,穿过根尖膜。带正电的离子,如Ca2+和Na+,更容易穿过顶膜进入带负电的细胞胞浆,因为它们正向下移动其电梯度。然而,在细胞的另一边,将带正电的矿物质(如Ca2+或Na+)从细胞内穿过基底侧膜转移到细胞外液中将涉及到将这些离子转移到一个与其电场梯度相反的更积极的环境中。
胃肠道的吸收细胞通常有专门的机制,允许有效地吸收许多可溶性矿物质,即使它们在饲粮中的浓度相当低。这就是所谓的跨细胞转运,这是一个分3步进行的过程。在步骤1中,矿物质从消化液中穿过未溶解的水层和糖萼,到达顶膜表面(图1)。这种矿物质必须溶于浸在细胞表面的消化液中才能发生。但是,构成细胞膜的磷脂双层对水和矿物质完全不渗透。为了允许水溶性矿物质穿过磷脂双层进入细胞,细胞利用矿物质或“离子”通道(转运蛋白)。这些由细胞膜中促进矿物质扩散的特殊蛋白质组成。一般来说,这些转运蛋白只有在矿物处于离子化状态时才会与矿物结合,在许多情况下,转运蛋白只有在矿物具有一定的价态或电荷时才会与矿物结合。在某些情况下,通道或运输蛋白受到调节,只有当身体需要特定的矿物质时,才允许矿物质通过顶膜。当与另一种分子共转运时,其他矿物质穿过膜。
在跨细胞运输的第二步中,矿物质必须穿过细胞的胞质溶胶从细胞的顶膜移动到基底外侧膜。对于某些矿物质来说,这是通过细胞内的简单扩散实现的。对于大多数矿物质来说,特殊的蛋白质,或者在某些情况下,运输小泡执行这一功能。这些转运蛋白,通常被称为伴侣蛋白,有另一个重要的功能:它们结合矿物质,使其不在细胞质中以游离的电离状态存在,因为这可能会影响细胞功能。例如,细胞溶质中Ca2+浓度的增加可以作为“第二信使”来启动各种细胞代谢途径,通常是对激素或细胞因子的反应。此外,许多矿物质在游离未结合状态下具有强氧化性,因此必须结合以防止对细胞的损伤。此外,一旦到达胞质溶胶,这些转运蛋白通过结合离子,也有助于保持胞质溶胶中离子化矿物质的低浓度。这通过沿浓度梯度向下扩散来促进离子进一步流入心尖膜。
最后,在第三步中,矿物质必须从上皮细胞的胞质溶胶中穿过基底外侧膜移至紧密连接处下方的间隙空间。在某些情况下,矿物质可以通过基底外侧膜中的蛋白质通道向下扩散其浓度或电梯度。然而,在许多情况下,该过程包括将矿物质从低浓度区域(细胞内部)移动到高浓度区域(细胞外液)。将一种矿物质逆着其浓度梯度,或许也逆着其电梯度移动到细胞外液中,通常需要在基底外侧膜内形成矿物质泵的特殊蛋白质。这些泵通常需要消耗ATP形式的能量来驱动泵送机构。离子交换剂可以利用离子沿其电化学梯度移入或移出电池所产生的势能来推动其他离子逆着其电化学梯度移入或移出电池。一种常见的策略是利用1个或多个Na+沿其大浓度和电梯度进入细胞所产生的力来驱动其他离子或分子穿过顶膜进入细胞或通过基底外侧膜将离子移出细胞。然后,然后,电原性Na+/K+ ATP酶泵通过将3个Na+移回细胞外液并让2个K+进入细胞,恢复正常的细胞Na浓度和膜电位。
一旦离子、葡萄糖、短链脂肪酸或氨基酸被输送到间隙空间,它们会产生渗透梯度,将水拉入间隙空间。这些水可以通过利用某些紧密连接蛋白(如Claudin-2)形成的紧密连接中的孔进入这个空间。水也可以走跨细胞路线。水可以跟随溶质穿过顶膜进入胞质溶胶,然后跟随溶质穿过基底外侧膜,通过称为水通道蛋白的水通道进入间隙空间。
活跃的跨细胞矿物质转运过程允许动物从饲粮中吸收矿物质,即使它们在肠腔中的浓度非常低。运输机制通常对给定的矿物非常特殊,并且容易饱和,这意味着它们在给定的时间内只能运输有限量的矿物。在某些情况下,当身体需要特定的矿物质时,这些转运系统的效率可以上调,或者当身体有充足的矿物质供应时,这些转运系统的效率可以下调。这些运输过程也可能存在拮抗剂。例如,高饲粮铁会干扰小肠对锌的吸收。
二、细胞旁吸收与细胞间吸收
为了保持紧密连接和矿物质的细胞旁吸收的作用,考虑肠道中紧密连接所代表的表面积的大小是很有趣的。小肠表面的鸟瞰图表明,大约8%的表面由细胞之间紧密的连接组成。然而,当考虑每个肠细胞的微绒毛贡献的表面积时,与腔内液体接触的紧密连接表面仅约为可用吸收表面积的0.1%。这意味着超过99%的吸收表面被细胞顶膜衬着,伴随着它们的跨细胞运输机制。当饲料中矿物质含量较高时,通过紧密连接的阳离子或阴离子孔扩散的矿物质的细胞旁吸收可能占主导地位。然而,当饲粮中的矿物质含量很少时,跨细胞运输机制更可能是矿物质吸收的主要原因。矿物质通过瘤胃和小肠及大肠中紧密连接的水孔的溶剂拖曳作用很难量化。据推测,只有在净吸收水的地方,矿物质的溶剂拖曳才能促进动物的营养。反刍动物的瘤胃、回肠和结肠的净吸水量最大。皱胃、十二指肠和上空肠实际上是反刍动物净分泌水分的场所。随着水从管腔内的摄入物中排出,摄入物中残留的矿物质浓度(mol/L)会增加。内腔中矿物质浓度的增加将有助于矿物质通过紧密连接的孔被动扩散。
三、大分子化合物和酸碱生理学
酸碱生理学传统上是基于布朗斯特德和劳里的观点,他们独立地提出酸是一种能提供质子(H+)的物质,碱是一种能接受质子的物质。处于非缔合状态的弱酸可以称为透明质酸。这种透明质酸被认为是一种酸,因为它能提供一个质子。有多少透明质酸会离解,由酸离解常数的负对数(以10为底)来描述(pKa)。在解离状态下,弱酸可以用它的成分来描述:一个H+和一个阴离子A-。弱酸的阴离子被认为是碱,因为它能接受质子。亨德森-哈苏方程,酸碱度= pKa +log10(碱/酸),长期以来一直在临床上有用,因为当考虑生物液体中的弱酸或弱碱时,它可以很容易地预测酸碱度的变化。血液酸碱度尤其如此,考虑到碳酸氢盐缓冲系统,血液酸碱度通常被描述为pH=6.1+log10(HCO3-/H2CO3)。血液中H2CO3的量与血液中CO2的量和CO2在水中的溶解度成正比。呼吸作用将二氧化碳从体内移除,这实质上从系统中移除H2CO3(酸),增加了酸碱度。代谢过程和其他可能的酸和碱在酸-碱状态中的作用在这种方法中通过阴离子间隙方程来解决,其中阴离子间隙=([Na+] +[ K+ ])([Cl-]+[ HCO3- ])。阴离子间隙的值通常在10和20 mEq/L等离子体之间。低于正常值时,提示动物有碱中毒;当过高时,意味着酸中毒。
从营养的角度来看,传统的亨德森-哈苏酸碱生理学方法的一个主要问题是,它不能预测喂食CaCl2等阴离子盐对动物血液酸碱度的影响。幸运的是,还有另一种方法来考虑酸碱生理学,该方法考虑了强离子(如钠、氯和钾)和弱酸对溶液酸碱度的影响。它被称为强离子差异方法,由加拿大医生彼得·斯图尔特倡导。他们认为酸是一种物质,当溶解在水中时,会增加溶液中H+的浓度。碱是一种物质,当溶解在水中时,会降低H+的浓度。
在任何溶液中,无论是血液、细胞胞液、肠腔液还是一升水,都必须有等量的正电荷和负电荷。随着改变溶液电荷的原子的存在,通过水(H2O ↔ H+ + OH-)的离解来控制H+和OH-浓度。血液电荷的改变迫使水达到新的平衡状态。在正常血液中,阳离子的数量略多于阴离子的数量,使正常血液的酸碱度呈微碱性。血液中的氢离子浓度必须保持在非常严格的限度内,机体才能存在。以负对数表示,静脉血的pH (log 1/H+)通常约为7.36 (H+浓度= 0.000000043M)。如果静脉血pH值降至7.2以下(H+浓度= 0.000000064M)或升高至7.6以上(H+浓度= 0.000000025M),动物将会严重患病或死亡。血液电荷,也就是酸碱度,取决于三个因素。第一个是呼吸作用,根据亨德森-哈苏方程的预测,只要呼出二氧化碳,就会以碳酸氢根阴离子的形式从血液中去除负电荷。其次是血液中蛋白质的浓度。蛋白质主要在肝脏中产生,通常带负电荷。第三是血液的强离子差异。强离子是血液中携带正电荷或负电荷的矿物质。最终,它们从动物的饲粮中进入血液和身体。
四、矿物质作为助氧化剂和抗氧化剂
在分解代谢过程中,会产生称为自由基的极其危险的化合物。自由基是任何能够独立存在且包含1个或多个未配对电子的原子或分子。未配对电子使自由基不稳定且非常活跃;它们倾向于从邻近的化合物中移去一个电子,或者把多余的电子给其他的分子或原子。细胞呼吸过程中产生的常见自由基包括超氧阴离子(O2-)、过氧化氢(H2O2)和羟基自由基(OH·)。这些通常被称为活性氧。活性氧试图从或提供电子的主要目标包括一氧化氮(产生活性氮,如过氧亚硝酸盐)和多不饱和脂肪酸中发现的细胞膜脂质双分子层中的碳-碳双键。活性氮的形成消耗血液中的一氧化氮,一氧化氮是调节血液流向组织的血管平滑肌收缩的重要中介物。活性氮与分子内的金属相互作用,如血红蛋白和铜蓝蛋白,干扰其功能。活性氮对DNA的损害可以引起DNA的交联和阻断转录。活性氧对细胞膜脂质的过氧化作用会导致细胞膜失去完整性并出现渗漏。
通过从另一个分子中窃取一个电子或向另一个分子提供一个额外的电子,自由基变得稳定而不反应。然而,自由基的毁灭性问题是,它们从“稳定”的分子中窃取电子,或提供一个电子,现在会有一个未配对的电子,所以它现在变成了一个自由基。新的自由基——例如细胞膜上的一种不饱和脂质,它失去了一个电子,现在变成了脂质过氧化物——反过来会从其他分子上夺取电子,引发电子移除或捐赠的连锁反应,这将影响更多的分子,直到反应可以通过身体的抗氧化系统的作用停止。
所有属于过渡元素的微量矿物(Fe、Cu、Zn、Mo、Cr和Mn)都具有较大的氧化还原电位,这意味着它们具有从其他分子获得电子的强烈趋势。然而,只有当它们在体液中处于自由、电离(带电)状态时,它们才能做到这一点。身体试图通过产生与金属离子形成可逆键的蛋白质来最大限度地减少体液中游离金属的存在,其中电子被蛋白质分子暂时共享或捐赠给金属。这可以防止金属从脂质、DNA或其他更容易窃取电子而不是共享电子的分子中提取电子。这些金属结合蛋白存在于细胞内外。血液中常见的金属结合蛋白包括白蛋白(低亲和力、高容量)和更特异的转运蛋白,如转铁蛋白或铜蓝蛋白(高亲和力、低容量)。在这些特定的蛋白质载体中,金属与蛋白质分子亲水区域中氨基酸侧链上的1个或多个氮或氧基团连接,例如赖氨酸、组氨酸和谷氨酸。通常,这一区域被水屏蔽,水可能会将蛋白质上的金属包覆在蛋白质上的疏水性AA中,从而使蛋白质脱离金属。不幸的是,当摄入大量金属时,吸收的金属可能比金属结合蛋白能成功结合的金属多。此时,游离的离子化金属浓度开始增加,导致组织损伤。典型症状包括红细胞溶解引起黄疸(铜和锌毒性)或血小板溶解引起广泛出血(铁毒性)。
结论
本文主要描述了矿物质吸收的一般模型,论述矿物质吸收的一个主要障碍是饲粮能否将足够的矿物质以电离形式提供给肠细胞的顶膜,以供跨细胞吸收。一般来说,当饲粮中矿物质浓度微乎其微时,跨细胞吸收对于动物满足矿物质需求是至关重要的。矿物可分为带正电的阳离子和带负电的阴离子。吸收的阳离子与阴离子的相对量有助于确定动物的酸碱状态。几种矿物质作为抗氧化剂的辅助因子发挥着重要作用,有助于减轻氧化压力。然而,当过量喂养时,这些矿物质实际上会促进自由基的形成,从而促进氧化应激。

