第146期:短链脂肪酸可以不依赖于猪肠道微生物区系改善脂肪和葡萄糖代谢
论文ID
原名:Short-chain fatty acids can improve lipid and glucose metabolism independently of the pig gut microbiota
译名:短链脂肪酸可以不依赖于猪肠道微生物区系改善脂肪和葡萄糖代谢
作者:Hua Zhou1,2, Bing Yu1,2, Jing Sun3,4, Zuohua Liu3,4, Hong Chen5, Liangpeng Ge3,4* and Daiwen Chen1,2*
完成单位:
* Correspondence: geliangpeng1982@163.com; dwchen@sicau.edu.cn
1 Key Laboratory of Animal Disease-Resistance Nutrition, Chengdu 611130,Sichuan, China.
2 Animal Nutrition Institute, Sichuan Agricultural University,Chengdu 611130, Sichuan, China.
3 Key Laboratory of Pig Industry Sciences,Rongchang 402460, Chongqing, China.
4 Chongqing Academy of Animal Sciences, Rongchang 402460, Chongqing, China.
5 College of Food Science,Sichuan Agricultural University, Ya’an 625014, Sichuan, China.
期刊:Journal of Animal Science and Biotechnology
影响因子:4.169
发表时间:2021-05-06

1、摘要
背景:已有研究表明,外源性短链脂肪酸(SCFAs)可减弱常规小鼠和猪体内脂肪沉积。然而,少量的研究是独立于肠道微生物区系来评估外源引入的单链脂肪酸对脂肪和葡萄糖代谢的影响。本研究旨在探讨外源导入单链脂肪酸(SCFA)对无菌(GF)猪模型脂代谢和糖代谢的影响。
方法:将12头子宫切除后的新生仔猪在6个无菌隔离器中饲养。在第二个21d期间,6头猪每天口服25mL/kg无菌生理盐水,为GF组,其余6头猪每天口服25mL/kg SCFAs混合物(醋酸、丙酸、丁酸,分别为45、15、11 mmol/L),为FA组。
结果:口服SCFAs可提高血清脂联素浓度,增强背最长肌CPT-1活性,上调结肠ANGPTL4 mRNA表达水平(P<0.10)。同时,FA组肝脏ACC、Fas、SREBP-1C和背最长肌CD36的mRNA丰度均低于GF组(P<0.05)。此外,FA组肝脏组织PGC-1α mRNA表达呈上调趋势,背最长肌脂蛋白α表达呈下调趋势(P<0.01)。此外,口服SCFAs可使肝脏GPR43蛋白水平升高(P<0.10),ACC蛋白水平降低(P<0.10)。口服SCFAs可上调肝组织p-AMPK/AMPK比值和GLUT-2、GYS2 mRNA表达(P<0.05)。此外,口服SCFAs对不饱和脂肪酸生物合成的代谢途径有极显著的促进作用(P<0.05)。
结论:外源性单链脂肪酸可减轻猪模型的脂肪沉积,并在一定程度上改善血糖控制,这种作用不依赖于肠道微生物区系。
2、试验设计
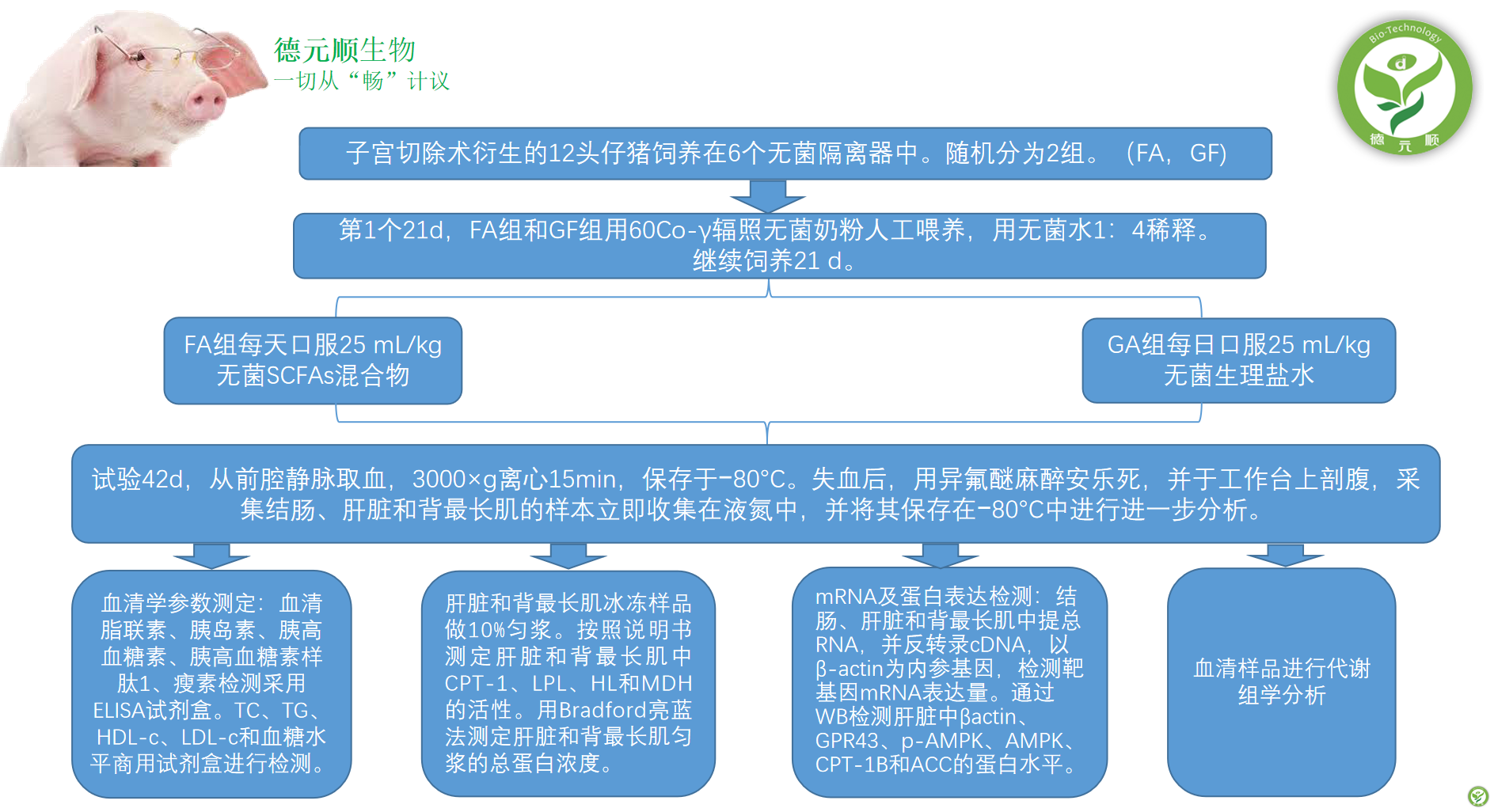
3、结果与分析
3.1 血清参数
表1:外源性SCFAs对GF猪血清参数的影响
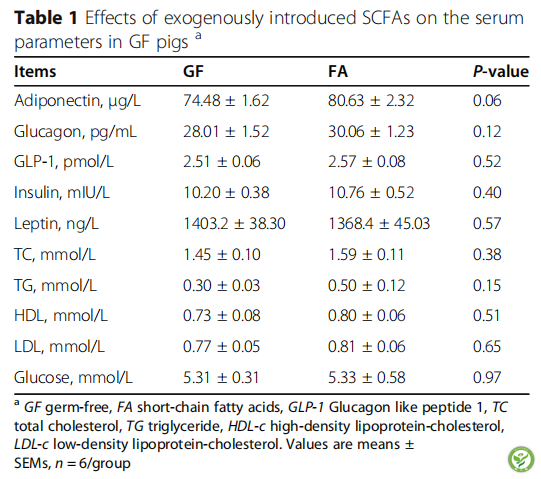
口服SCFAs对血清参数的影响见表1。与GF组相比,FA组血清中脂联素含量有升高的趋势(P<0.10)。
3.2肝脏和背最长肌中酶的活性
表2:外源性SCFAs对GF猪肝脏和背最长肌脂质代谢酶相关活性的影响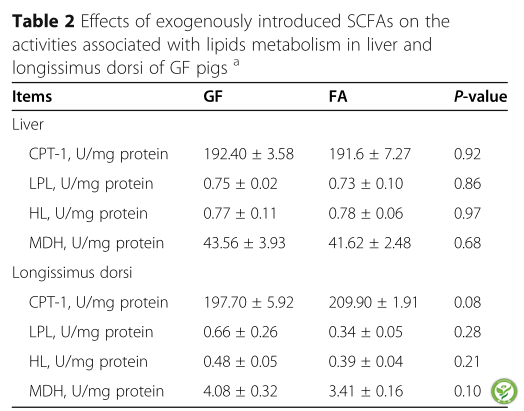
肝脏和背最长肌的酶活性见表2。FA组背最长肌CPT-1活性有高于GF组的趋势(P< 0.10)。
3.3 肝脏和背最长肌脂质代谢相关基因的相对mRNA表达
表3:外源性SCFAs对GF猪结肠和肝脏脂质代谢相关关键因子mRNA丰度的影响
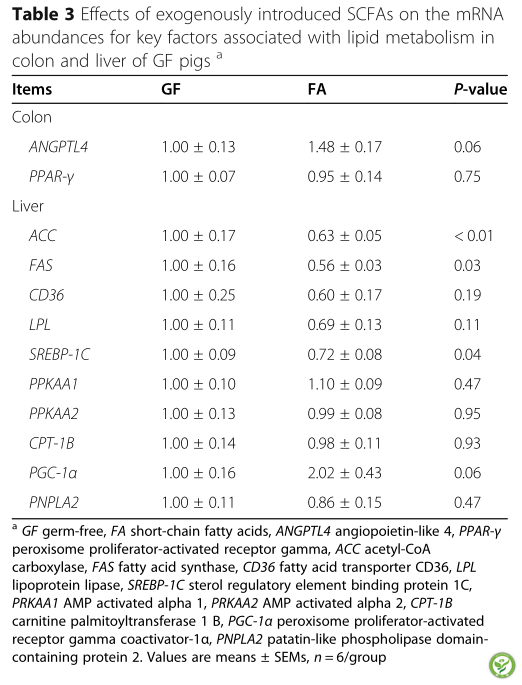
表4:外源性SCFAs对GF猪背最长肌脂质代谢关键因子mRNA丰度的影响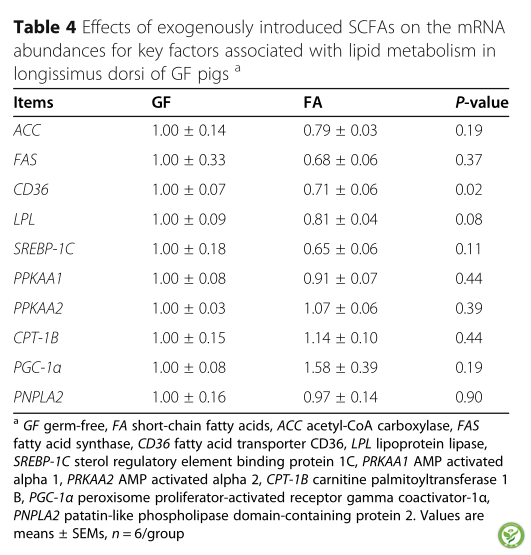
如表3所示,与GF组相比,FA组结肠中ANGPTL4和肝脏中PGC -1α的mRNA表达有上调的趋势(P< 0.10)。FA组肝组织中ACC、FAS、和SREBP-1C mRNA丰度均低于GF组(P< 0.05)。如表4所示,口服SCFAs可降低CD36 mRNA的表达(P < 0.05)而背最长肌中LPL mRNA的表达有下调趋势(P< 0.10)。
3.4 肝脏和背最长肌葡萄糖代谢相关基因的相对mRNA表达
表5:外源性SCFAs对GF猪肝脏糖代谢相关关键因子mRNA丰度的影响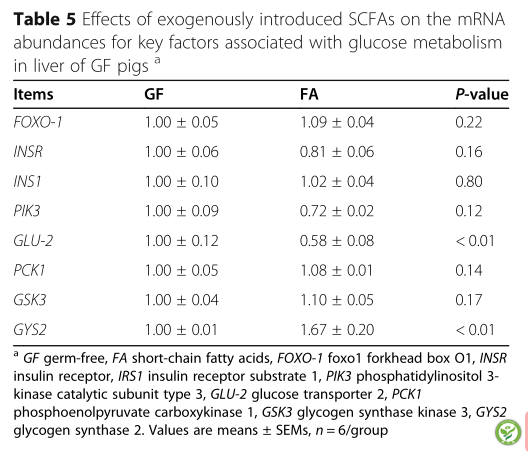
表6:外源性SCFAs对GF猪背最长肌糖代谢相关关键因子mRNA丰度的影响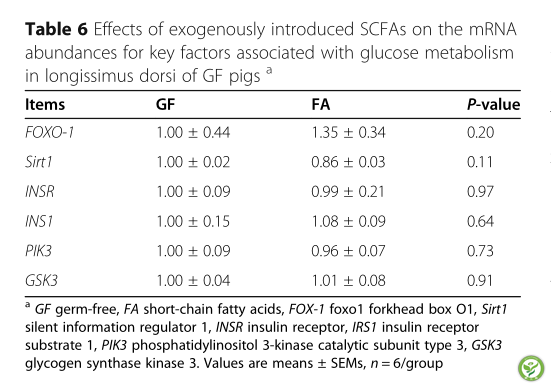
如表5所示,SCFAs可上调肝脏中GLU -2和GYS2的mRNA表达(P< 0.05)。此外,FA组和GF组背最长肌糖代谢相关基因mRNA丰度无差异(P> 0.10)(表6)。
3.5 与脂质代谢相关的蛋白质水平
图1:外源性SCFAs对GF猪肝脏中GPR43、p-AMPK、AMPK、CPT-1B和ACC蛋白水平的影响
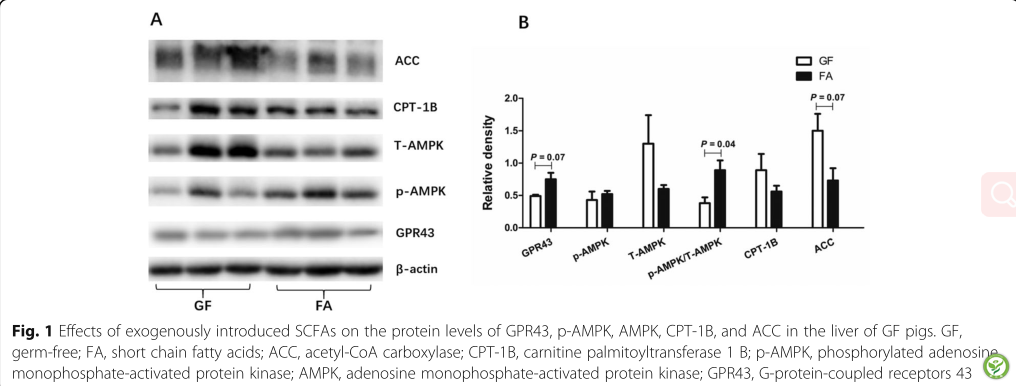
GF,无菌;FA,短链脂肪酸;ACC,乙酰辅酶a羧化酶;CPT-1B,肉碱棕榈酰基转移酶1b;磷酸腺苷活化蛋白激酶p-AMPK;腺苷磷酸活化蛋白激酶AMPK;g蛋白偶联受体。
由图1可知,口服SCFAs有升高GPR43蛋白水平(P< 0.10),降低ACC蛋白水平(P< 0.10)的趋势,而上调肝脏中P -AMPK/AMPK比值(P< 0.05)。
3.6 血清代谢组学
图2:PCA、PLS-DA和OPLS-DA评分图
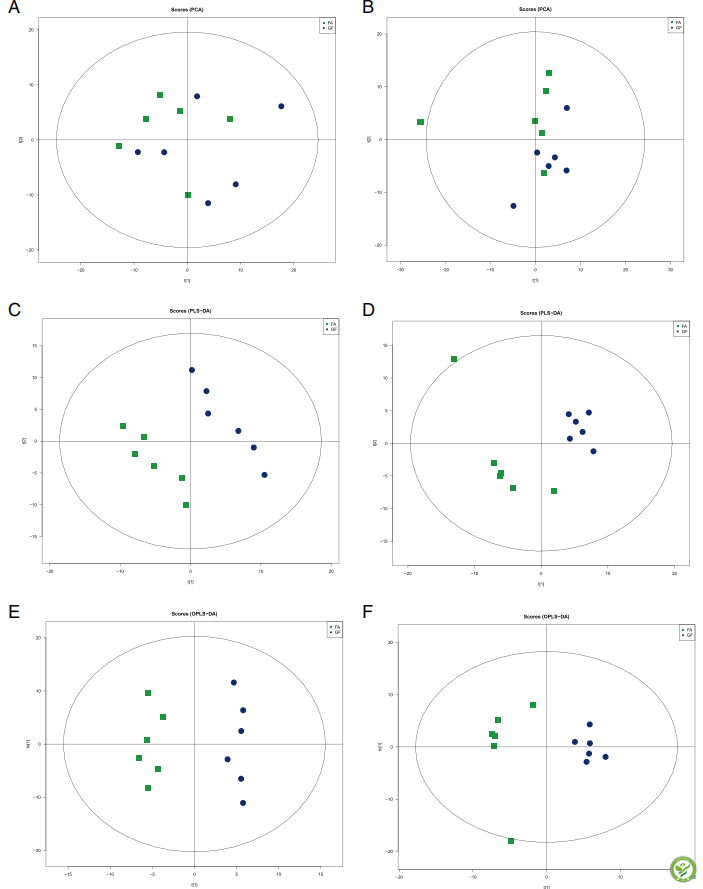
采用PCA、PLS-DA和OPLS-DA对LC-MS数据集进行可视化,显示样本之间的异同。GF组与FA组间PCA分析无明显差异(图2a、b)。为了进一步分析GF组与FA组间的差异,采用PLS-DA和OPLS-DA分析。PLS-DA(图2c, d)和OPLS-DA(图2e, f)评分图显示了GF和FA组在正模式和负模式下的分离。
图3:火山图显示所有代谢物的分布
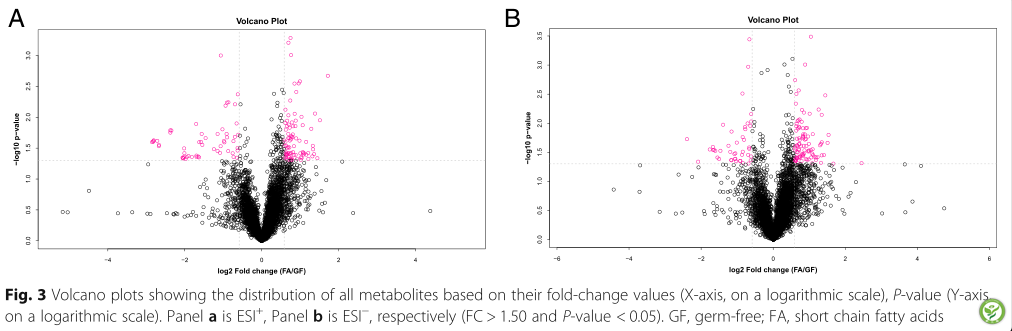
倍数变化值(x轴为对数刻度),p值(y轴为对数刻度)。Panelais ESI+, Panelbis ESI−(FC > 1.50, p -value < 0.05)。GF,无菌;FA,短链脂肪酸。
如图3所示,通过单变量测量显示GF和FA组之间的差异代谢物变化。红点代谢物在FC > 1.5和p -value < 0.05的GF和FA组之间存在差异。
图4:ESI+(a)和ESI−(b)中与猪血清显著差异的代谢产物的分级聚类热图
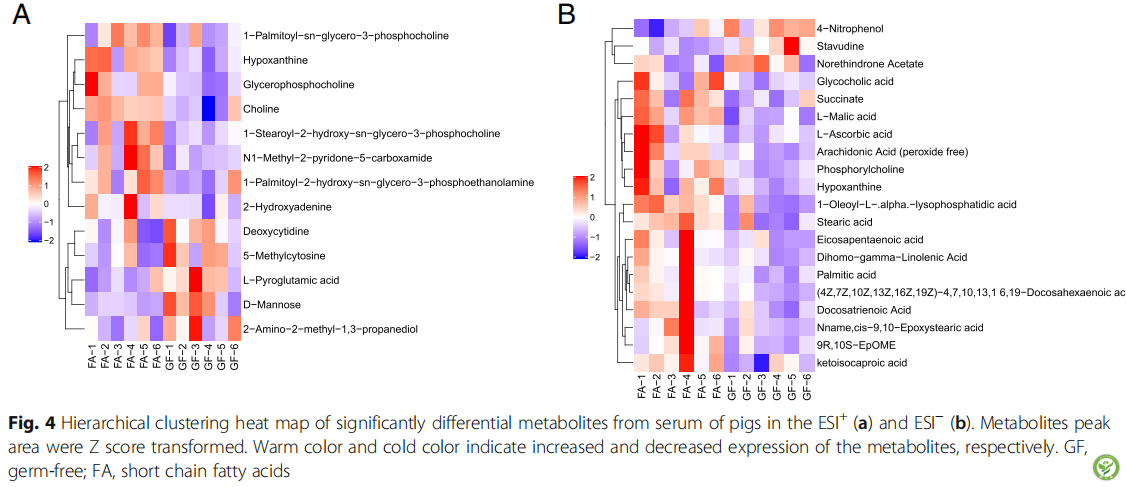
代谢物峰面积进行Z积分转换。暖色和冷色分别表示代谢物表达增加和减少。GF,无菌;FA,短链脂肪酸。
表7:FA组和GF组血清代谢物变化
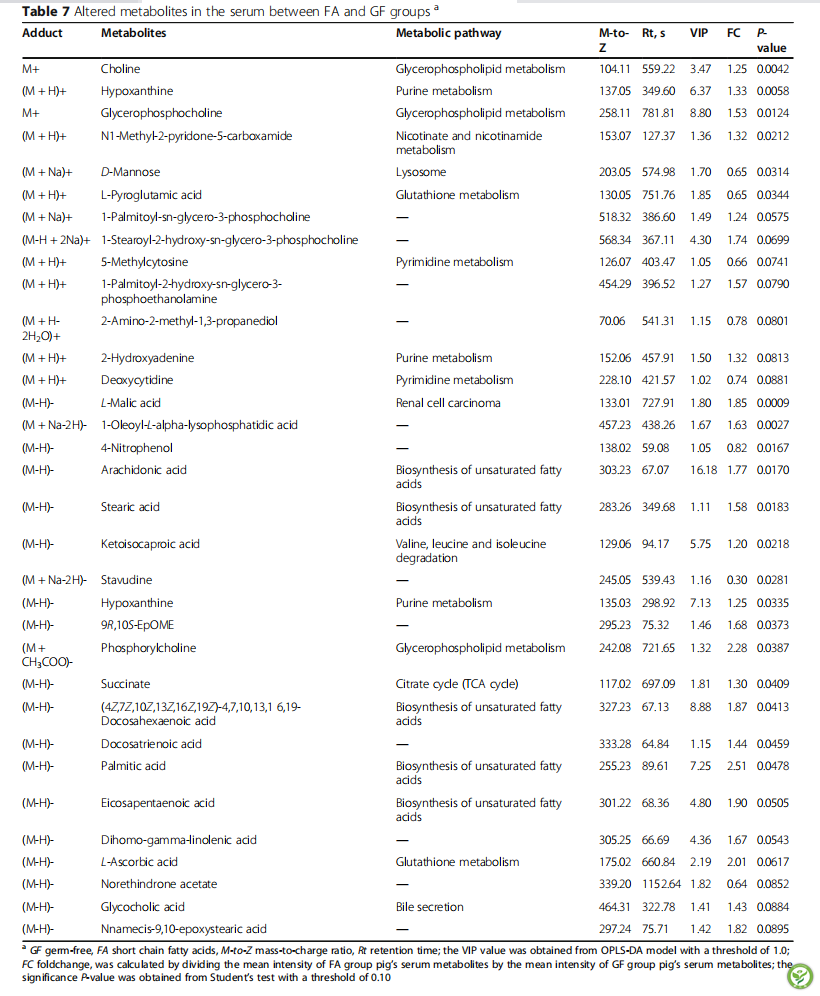
为了评估哪一种化合物导致了两组之间的差异,使用VIP > 1.0和adjusted dp < 0.10作为GF和FA组之间血清化合物分离的关键谱系(图4和表7)。共鉴定出33个VIP > 1.0, dp < 0.10的化合物。其中17种代谢物(胆碱、次黄嘌呤、甘油磷酸胆碱、n1 -甲基-2-吡啶酮-5-羧酸、l-苹果酸、1-油酰-l - α -溶血磷脂酸、花生四烯酸、硬脂酸、酮异己酸、次黄嘌呤、9R-10S-EpOME、磷酸化胆碱、琥珀酸、二十二碳六烯酸、二十二碳三烯酸、与GF组相比,FA组丰富(P< 0.05), 4种代谢物(D甘露糖、l -焦谷氨酸、4-硝基酚和司他夫定)减少(P< 0.05)。
综上所述,口服短链脂肪酸显著增加了脂类相关化合物(花生四烯酸、硬脂酸、二十二碳六烯酸、棕榈酸、甘油磷脂胆碱),说明外源短链脂肪酸对猪的脂类代谢有很强的影响。
图5:GF和FA组之间代谢途径的拓扑分析
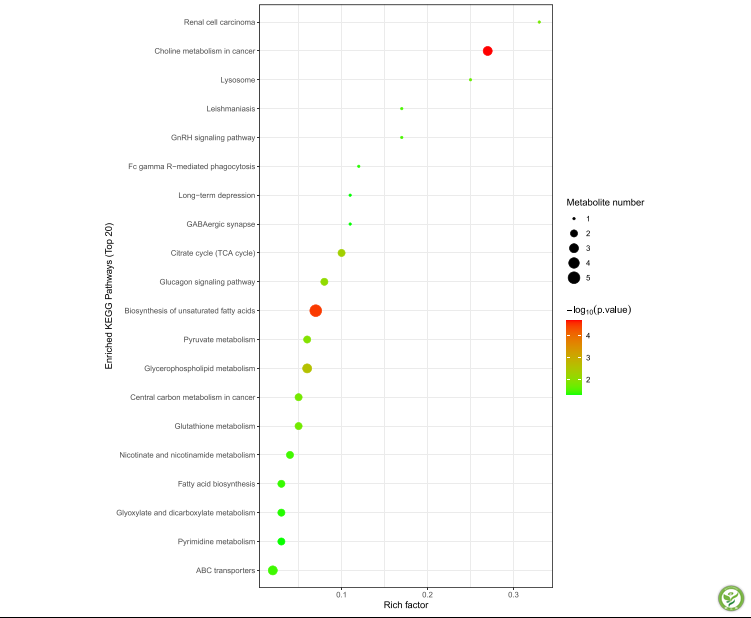
x轴表示丰富因子,y轴表示路径。较大的尺寸和较深的颜色分别代表更丰富的路径和更高的路径影响值。GF,无菌;FA,短链脂肪酸。
从图5可以看出,这些化合物参与了多个生化途径,外源SCFAs对不饱和脂肪酸生物合成的影响最为显著(P< 0.05)。
4、结论
综上所述,本研究表明,SCFAs可以减轻肝脏和背最长肌的脂肪沉积,并在一定程度上改善葡萄糖代谢,而这与肠道微生物群无关。外源性SCFAs可能通过与GPR43结合,激活AMPK-ACC通路,刺激GF猪不饱和脂肪酸生物合成代谢途径,从而降低脂肪含量,改善糖耐量。目前的工作进一步表明了肠道微生物存在的重要性,并提供了新的证据,表明SCFAs的外源性引入可能是一种预防代谢紊乱和抵消肠道微生物群缺乏或失衡的治疗策略。













