原标题:丁酸通过诱导抗菌性宿主防御肽基因的表达而增强鸡的抗病能力
Butyrate Enhances Disease Resistance of Chickens by Inducing Antimicrobial Host Defense Peptide Gene Expression
作者:Lakshmi T. Sunkara1 , Mallika Achanta1 , Nicole B. Schreiber1 , Yugendar R. Bommineni1¤a, Gan Dai1¤b,Weiyu Jiang1, Susan Lamont2, Hyun S. Lillehoj3, Ali Beker1, Robert G. Teeter1, Guolong Zhang1*
1 Department of Animal Science, Oklahoma State University, Stillwater, Oklahoma, United States of America,
2 Department of Animal Science, Iowa State University, Ames,
Iowa, United States of America,
3 Animal Parasitic Diseases Laboratory, Animal and Natural Resources Institute, United States Department of Agriculture-Agricultural Research Service, Beltsville, Maryland, United States of America
来源:PLoS ONE 6(11): e27225. DOI:10.1371/journal.pone.0027225
翻译:肠动力研究院 梁琦
【摘要】宿主防御肽(HDPs)构成一大类天然广谱抗菌物质,几乎是所有生命体免疫系统的第一道重要防线。内源性HDPs合成的特异性增强可能是一种非常有前景的替代抗生素从而控制疾病的新方法。本试验研究人员进行了这种假设:外源性给予丁酸(一种源于细菌发酵未消化的膳食纤维而产生的主要短链脂肪酸)能够诱导产生HDP并增强鸡的抗病能力。之后研究人员展开试验发现,丁酸是鸡HD11巨噬细胞、原代单核细胞、骨髓细胞、空肠和盲肠外植体中几种(但不是全部)的HDPs有效诱导物。此外,丁酸不仅可以增强鸡单核细胞对肠炎沙门氏菌的抗菌活性,而且对炎性细胞因子的产生,促进吞噬作用和细胞氧化迸发能力的影响最小。此外,日粮添加0.1%丁酸可显著提高鸡肠道HDP基因的表达。更重要的是,这样的饲养方式可致使大肠杆菌攻毒鸡的盲肠细菌滴度降低近10倍。研究结果表明:丁酸诱导合成的内源性HDPs是哺乳动物和鸟类共有的由先天宿主防御系统生成的活性物质,日粮添加丁酸作为一种恰当的替抗策略具有进一步发展的潜力(可增强宿主先天性免疫和抗病能力)。
以下是实验中相关图表
表1:实时PCR扩增鸡宿主防御肽和相关细胞因子的引物序列
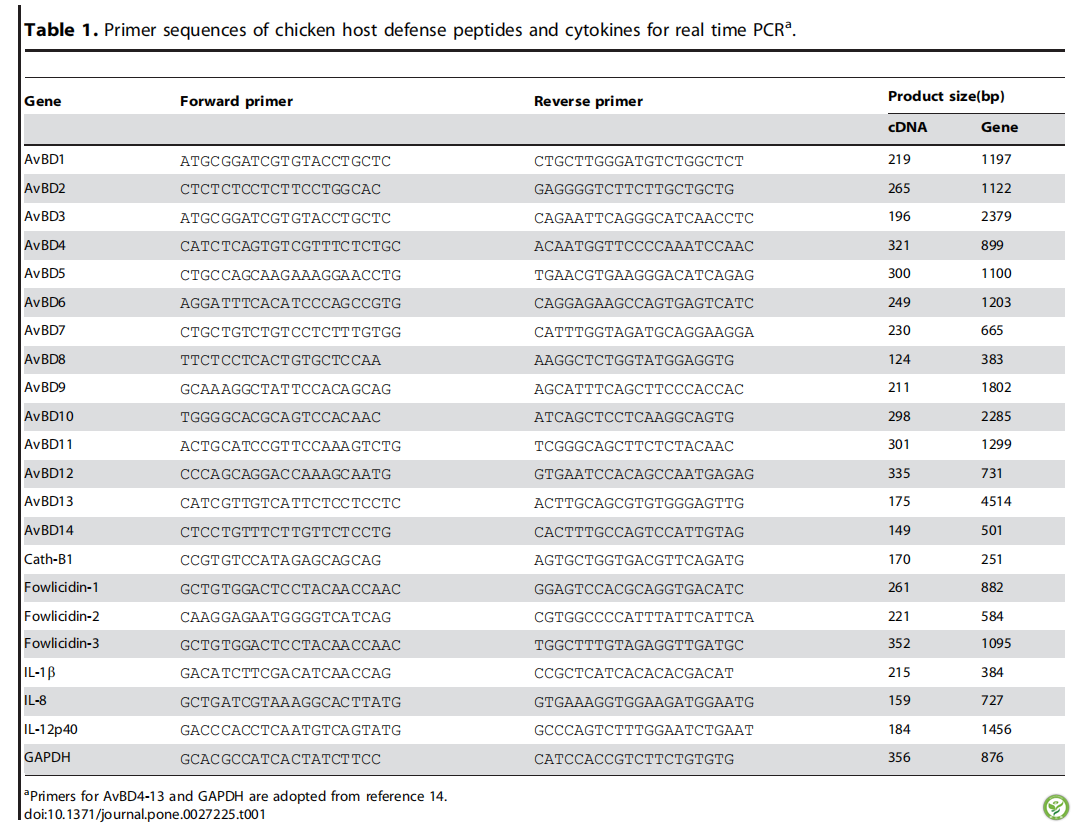
图1:丁酸诱导AvBD9基因在不同鸡细胞类型中的表达。HD11巨噬细胞与4 mM丁酸钠共作用2个时间点。图A:与指定的丁酸浓度作用24小时;图B:鸡初级单核细胞;图C:骨髓细胞;图D:在分离总RNA之前,将不同浓度的丁酸暴露24小时。实时RT-PCR分析AvBD9基因表达情况,对比DDCt法与GAPDH基因进行计算AvBD9基因相对于对照组的增加倍数。竖条表示平均值±标准误(通过两到三个独立实验得到)
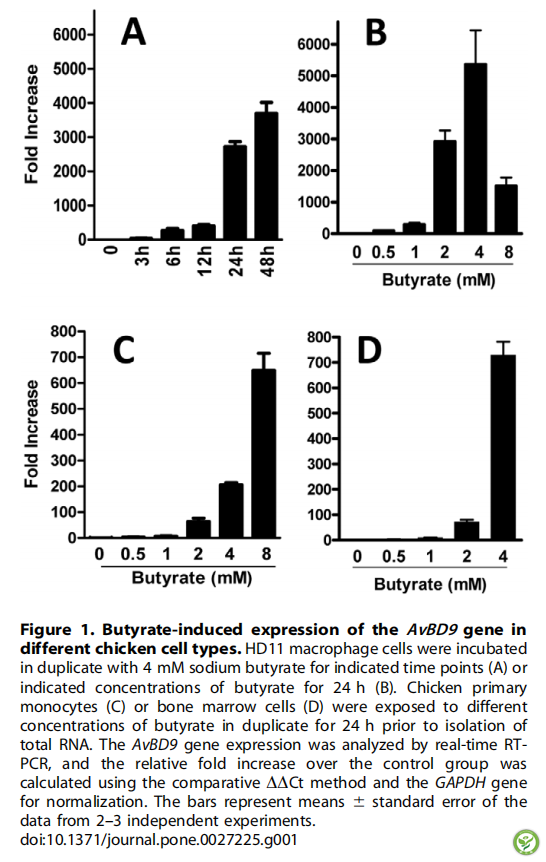
图2:诱导HDP基因在鸡HD11巨噬细胞和原代单核细胞中的表达。将鸡HD11巨噬细胞和原代单核细胞在不同丁酸浓度下培养24h,然后进行RNA分离和实时RT-PCR分析。颜色元素表示折线的平均对数,红色表示上调,黑色表示没有诱导,绿色表示下调。由于某些HDP在初级单核细胞中的表达水平极低,灰色区域表示没有数据。鸡HDPs按其受丁酸的诱导方式可分为三组,即一般诱导型(I)、不可调控型(II)和一般下调型(III)。AvBD11、AvBD12、AvBD13在两种细胞类型中均不能检测到,因此未显示。利用多实验浏览器生成热图
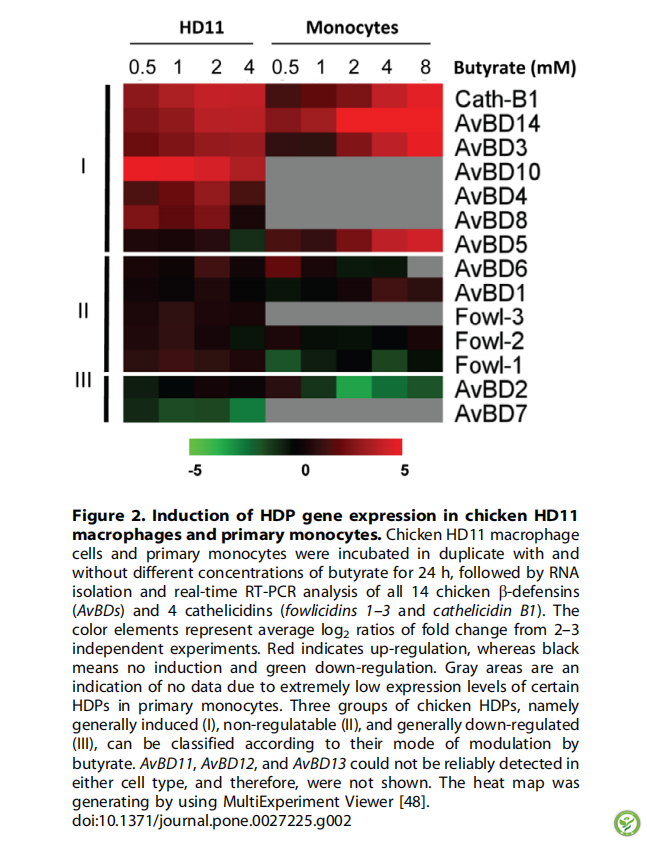
图3:丁酸上调鸡空肠(A)和盲肠(B)三种典型HDPs的表达。通过培养0.5 cm长的切片而获得鸡空肠和盲肠外植体,培养24 h后用指定浓度的丁酸作用。采用实时RT-PCR方法,采用DDCt法和GAPDH基因进行归一化,计算相对于对照组的增加倍数。竖条表示平均值±标准误(通过两到三个独立实验得到)
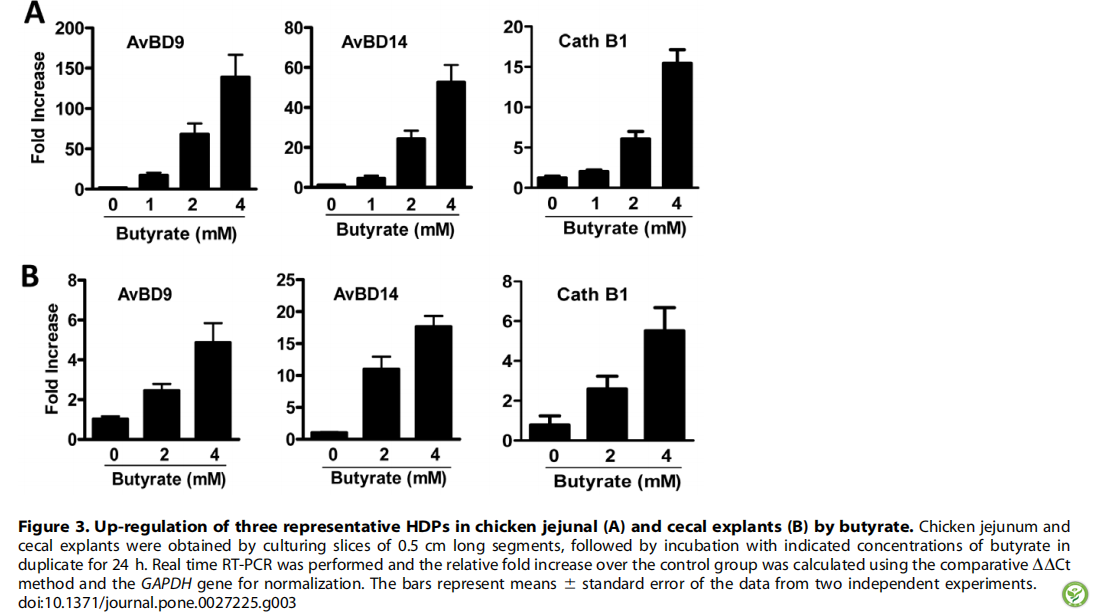
图4:丁酸诱导鸡肠道AvBD9基因表达。给2日龄雄性Cornish Rock肉鸡喂食添加或不添加0.1%和0.2%丁酸的标准日粮2天。从每只鸡收集作物,盲肠扁桃体和盲肠,并通过实时PCR评估AvBD9基因表达。条形表示均值+标准误差(来自6只不同鸡)。
图5:丁酸对HD11细胞中促炎性细胞因子合成的最小触发剂量。将鸡HD11巨噬细胞与指定浓度的丁酸或1mg / ml LPS作用3小时和24小时,然后对IL-1b(A),IL-12p(B)和IL-8(C)的基因表达进行实时PCR分析。条形表示均值+标准误差(通过两个独立实验)。丁酸刺激后3小时和24小时,IL-1和IL-12p40含量基本没有变化,只有丁酸处理24小时后,IL-8含量才出现中度上升。
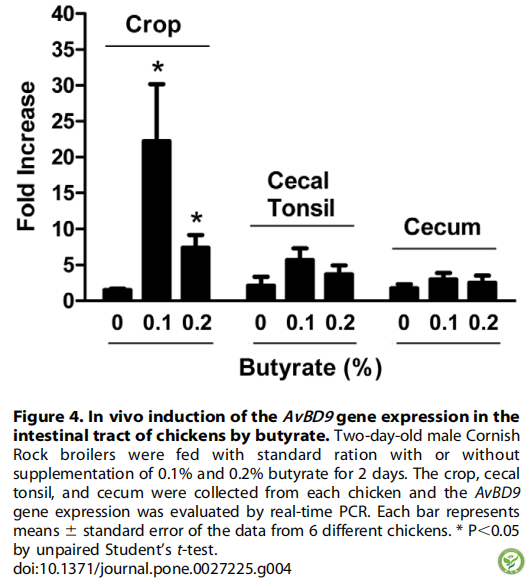
图5:丁酸对HD11细胞中促炎性细胞因子合成的最小触发剂量。将鸡HD11巨噬细胞与指定浓度的丁酸或1mg / ml LPS作用3小时和24小时,然后对IL-1b(A),IL-12p(B)和IL-8(C)的基因表达进行实时PCR分析。条形表示均值+标准误差(通过两个独立实验)。丁酸刺激后3小时和24小时,IL-1和IL-12p40含量基本没有变化,只有丁酸处理24小时后,IL-8含量才出现中度上升。
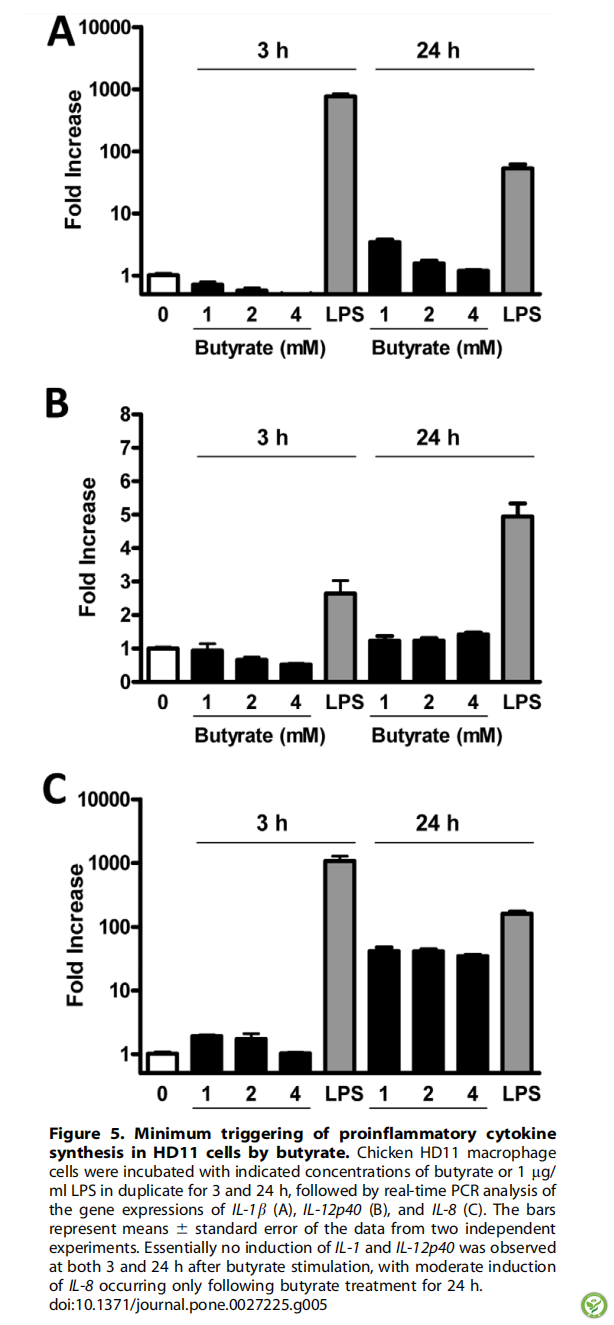 图6:丁酸刺激后单核细胞的抗菌活性增强。用不同浓度的丁酸处理或不处理鸡单核细胞24小时。然后制备细胞裂解物并与肠炎沙门氏菌(ATCC 13076)在37℃混合9小时。测量OD590nm处的细菌浊度作为细菌密度的指标。肠炎沙门氏菌也直接与不同浓度的丁酸在单独的细胞培养基中混合,没有单核细胞作为对照(白色条)。竖条表示平均值±标准误(通过两个独立实验得到)
图6:丁酸刺激后单核细胞的抗菌活性增强。用不同浓度的丁酸处理或不处理鸡单核细胞24小时。然后制备细胞裂解物并与肠炎沙门氏菌(ATCC 13076)在37℃混合9小时。测量OD590nm处的细菌浊度作为细菌密度的指标。肠炎沙门氏菌也直接与不同浓度的丁酸在单独的细胞培养基中混合,没有单核细胞作为对照(白色条)。竖条表示平均值±标准误(通过两个独立实验得到)
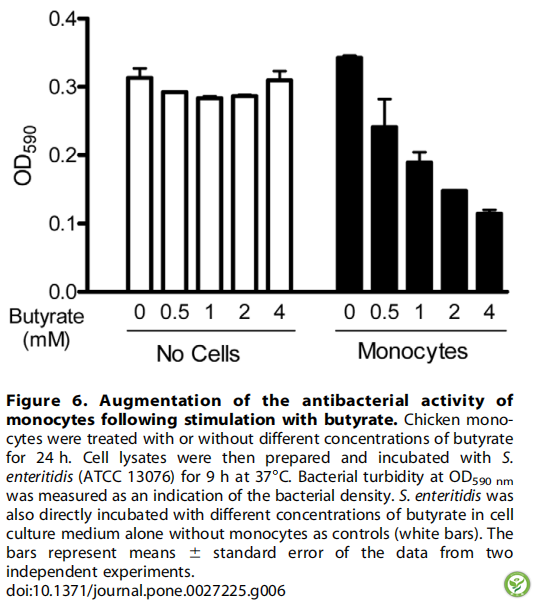 图7:丁酸对吞噬细胞(A)或HD11细胞氧化分裂活性(B)没有影响。在吞噬作用测定中,将鸡HD11巨噬细胞与不同浓度的丁酸作用24小时,然后在5%鸡血清下,37℃下暴露于肠炎沙门氏菌噬菌体13a型30分钟。然后用庆大霉素杀灭细胞外细菌,并在含有20 mg/ml纳利地酸的鲜绿色琼脂平板上连续37℃过夜,从裂解的HD11细胞中提取内化细菌。在氧化分裂实验中,HD11细胞用指定浓度的丁酸刺激24h。在含有或不含有PMA的情况下,与DCFA一起作用1小时后,在485nm和528nm下监测荧光。相对于每个样品的蛋白质浓度,将结果标准化。竖条表示平均值±标准误(通过两个独立实验得到)
图7:丁酸对吞噬细胞(A)或HD11细胞氧化分裂活性(B)没有影响。在吞噬作用测定中,将鸡HD11巨噬细胞与不同浓度的丁酸作用24小时,然后在5%鸡血清下,37℃下暴露于肠炎沙门氏菌噬菌体13a型30分钟。然后用庆大霉素杀灭细胞外细菌,并在含有20 mg/ml纳利地酸的鲜绿色琼脂平板上连续37℃过夜,从裂解的HD11细胞中提取内化细菌。在氧化分裂实验中,HD11细胞用指定浓度的丁酸刺激24h。在含有或不含有PMA的情况下,与DCFA一起作用1小时后,在485nm和528nm下监测荧光。相对于每个样品的蛋白质浓度,将结果标准化。竖条表示平均值±标准误(通过两个独立实验得到)
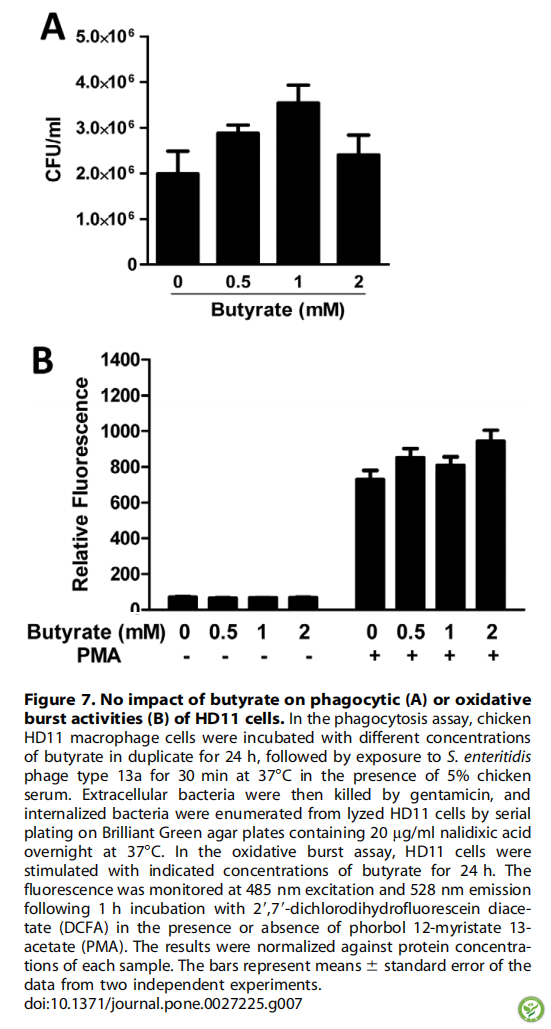
图8:丁酸对HD11细胞活化状态无影响。HD11细胞经4mm丁酸、1mg /ml LPS作用或24h未处理后,用荧光异硫氰酸酯(FITC)偶联的抗鸡MHC II类单克隆抗体进行MHC I、II类表面表达量的流式细胞仪分析图。所示数据是两个独立实验的均值。
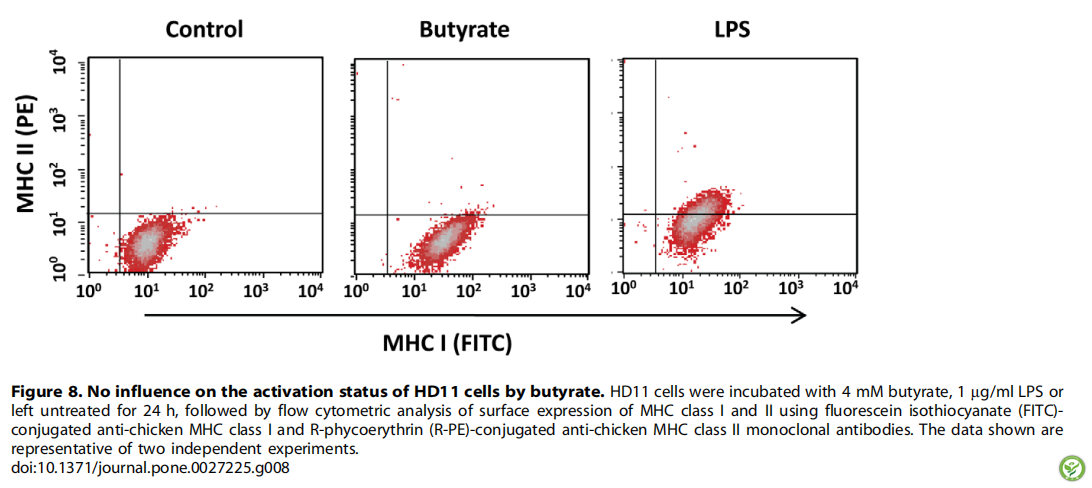
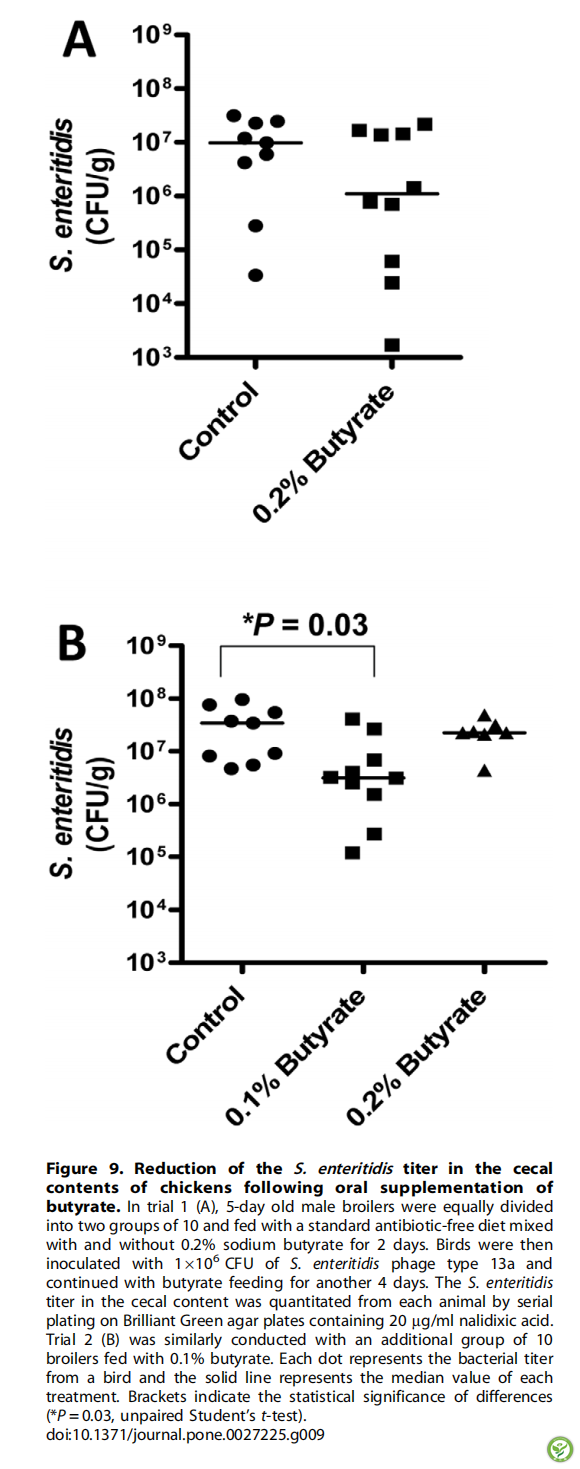
图9:口服丁酸后鸡盲肠内肠炎沙门氏菌滴度降低。在试验1 (A)中,将5日龄的雄性肉鸡平均分为两组,每组10只,分别饲喂含有0.2%丁酸钠(不含0.2%丁酸钠)的标准无抗生素日粮2天。然后用1×106 CFU接种13a型肠炎沙门氏菌,再用丁酸喂养4天。通过在含有20mg / ml萘啶酸的Brilliant Green琼脂平板上连续接种,从每只动物中定量测定盲肠内容物中的肠炎沙门氏菌滴度。试验2(B)类似地用另外一组饲喂含有0.1%丁酸的10只肉鸡。每个点代表来自鸡的细菌滴度,实线代表每种处理的均值。括号表示统计学上显著性差异。
Conclusion
总之,本文揭示了丁酸诱导合成内源性HDPs是一种哺乳动物和鸡共有的由先天宿主防御系统生成的活性物质。此外,研究人员认为丁酸诱导的HDP合成代表了一种新发现的机制,即在农场经济动物中,添加丁酸能够抑制细菌定植和并促进其脱落。丁酸、丁酸类似物以及其他短链脂肪酸具备抗炎作用和其他有益特性,可能具有进一步发展的潜力(可作为替抗物质或饲料添加剂),在不引起有害的促炎反应的情况下,它们能够增强人和动物的先天免疫和抗病能力。
Abstract
Host defense peptides (HDPs) constitute a large group of natural broad-spectrum antimicrobials and an important first line of immunity in virtually all forms of life. Specific augmentation of synthesis of endogenous HDPs may represent a promising antibiotic-alternative approach to disease control. In this study, we tested the hypothesis that exogenous administration of butyrate, a major type of short-chain fatty acids derived from bacterial fermentation of undigested dietary fiber, is capable of inducing HDPs and enhancing disease resistance in chickens. We have found that butyrate is a potent inducer of several, but not all, chicken HDPs in HD11 macrophages as well as in primary monocytes, bone marrow cells, and jejuna and cecal explants. In addition, butyrate treatment enhanced the antibacterial activity of chicken monocytes against Salmonella enteritidis, with a minimum impact on inflammatory cytokine production, phagocytosis, and oxidative burst capacities of the cells. Furthermore, feed supplementation with 0.1% butyrate led to a significant increase in HDP gene expression in the intestinal tract of chickens.More importantly, such a feeding strategy resulted in a nearly 10-fold reduction in the bacterial titer in the cecum following experimental infections with S. enteritidis. Collectively, the results indicated that butyrate induced synthesis of endogenous HDPs is a phylogenetically conserved mechanism of innate host defense shared by mammals and aves, and that dietary supplementation of butyrate has potential for further development as a convenient antibiotic-alternative strategy to enhance host innate immunity and disease resistance
Conclusion
In summary, we have revealed that butyrate-induced synthesis of endogenous HDPs is a phylogenetically conserved mechanism of innate host defense shared by both mammals and chickens. Moreover, we propose that butyrate-induced HDP synthesis represents a newly discovered mechanism that mainly accounts for the suppression of bacterial colonization and shedding in farm animals by butyrate. Coupled with anti-inflammatory effects and other beneficial properties, butyrate, butyrate analogs, and perhaps other short-chain fatty acids may have potential for further development as antibiotic-alternative food or feed additives to boost innate immunity and disease resistance of humans and animals without provoking a harmful proinflammatory response
如您需原文,请联系本文作者和出版方,或请垂询肠动力研究院。本网站发布的所有资料将尽最大可能注明出处、作者及日期,如无意中侵犯了您的知识产权,请来信及时告知,我们将立即予以删除。
All information released by the WeChat Official Account will do its best to indicate the source, author and date. If we inadvertently infringe on your intellectual property, please inform us in time and we will delete it immediately.









